INTRODUCCIÓN
La industria acuícola mundial mantuvo un crecimiento constante en el año 2022, alcanzando la producción de 130.9 millones de toneladas que representan un valor de mercado de 312 800 millones de dólares estadounidenses (USD), lo que representa un incremento de US$ 34 200 millones comparado con el año 2020 (FAO, 2024). Dentro de esta industria, la tilapia del Nilo (Oreochro-mis niloticus) representa el segundo grupo de peces de mayor producción a nivel mundial, después de la carpa, y es una especie con gran potencial para incrementar los volúmenes de producción en el futuro (FAO, 2023).
La actividad acuícola genera una serie de impactos que se ven agravados por efecto del cambio climático, entre los que destacan el alto consumo de agua y la eutroficación (Ottinger et al., 2016; Petroski et al., 2024). El pienso es considerado uno de los factores más importantes en la rentabilidad y sostenibilidad ambiental de la actividad, ya que representa entre el 50 al 70% de los costos de producción (Martins et al., 2011b; Baki y Yüsel, 2017; Llanes-Iglesias y Arboleya-Arizabalaga, 2022).
El pienso no consumido genera concentraciones elevadas de materia orgánica, que se descompone en amoniaco (Li y Boyd, 2016), afectando la salud de los peces y la calidad del efluente. A pesar de que desde inicio de este siglo se han desarrollado programas de selección para obtener fenotipos que presenten mejores rendimientos y reduzcan la producción de desechos (Nkrumah et al., 2006). Estos programas se basan principalmente en respuestas individuales en comportamiento y en estrés fisiológico (Silva et al., 2010). Los fenotipos seleccionados deben reunir algunas características, como variación individual (Toms et al., 2010) y la consistencia a lo largo del tiempo y en diferentes contextos (Budaev y Zworykin, 2002), conocida en la literatura como estilos de afrontamiento y personalidad animal (Koolhaas et al., 1999; Goslin, 2001).
En la literatura especializada se reconocen dos fenotipos por sus respuestas opuestas en comportamiento: proactivos y reactivos. Los proactivos, basado en adrenalina, se caracterizan por una respuesta de lucha-huida activa frente a los factores estresantes, además de una alta eficiencia alimentaria y motivación después de un cambio ambiental, dominio en encuentros agresivos y baja sensibilidad a los factores estresantes ambientales (Øverli et al., 2002). En contraste, los reactivos presentan un afrontamiento pasivo de conservación-retirada basado en el cortisol (Carere et al., 2005). Fisiológicamente, los peces proactivos exhiben rasgos como bajos niveles de cortisol basal y baja concentración de glucosa en sangre, en comparación con los reactivos (Leblanc et al., 2011; Balasch et al., 2019). Ante esto, el objetivo de este estudio fue evaluar el efecto de la variación en personalidad animal sobre indicadores de comportamiento, estrés y desempeño productivo de Oreochromis niloticus.
MATERIALES Y MÉTODOS
El estudio siguió los lineamientos del Comité Institucional de Bioética de la Universidad de Panamá, como parte de un proyecto mayor (CEIBA-UP-028-2021).
Ubicación y Animales Experimentales
El estudio se desarrolló en la Facultad de Ciencias Agropecuarias de la Universidad de Panamá, ubicada en Chiriquí, Panamá (8°23’18’’N; 82°19’50’’W), entre enero y abril de 2024. Se utilizaron 24 peces machos de tilapia del Nilo con peso inicial de 23.33 ± 1.29 g (media ± desviación estándar), previamente separados por la prueba de toma de riesgos en grupos, en tres fenotipos de comportamiento: proactivos (P), intermedios (I) y reactivos (R), adaptando la metodología propuesta por MacKenzie et al. (2009). El fenotipo I se descartó en este experimento. De esta manera, 12 peces proactivos (P) con peso inicial de 23.00 ± 1.22 g y 12 reactivos (R) con peso inicial de 23.65 ± 1.22 g formaron los tratamientos experimentales.
Parámetros Fisicoquímicos del Agua y Alimentación
Durante el experimento, la temperatura del agua se mantuvo en 28.06 ± 0.14 °C, oxígeno disuelto en 6.34 ± 1.26 mg/L y pH 6.87 ± 0.34. Las mediciones se realizaron diariamente con un equipo multiparámetro YSI 556 (HANNA®). Adicionalmente, se realizaron controles semanales de amoniaco, nitrito y nitrato empleando un fotómetro HI 83306 (HANNA®) obteniendo valores dentro de los rangos apropiados para la especie (Timmons y Ebeling, 2010). Los peces fueron alimentados durante la totalidad del experimento con un pienso comercial (EFICO Cromis 15, BioMar®) de 3 mm con 36% de proteína cruda a una tasa de 5% de su peso vivo.
Alojamiento e Identificación de los Peces
Se utilizaron dos tanques de 500 L con un volumen útil de 450 L. Ambos tanques fueron equipados con un sistema auxiliar de oxigenación, realizando un recambio semanal del tercio del volumen de agua. Se colocaron 6 peces P y 6 R por tanque. Los peces fueron marcados con implantes visibles de elastómero (Northwest Marine Technology®), con color azul en la zona post orbital derecha para P e izquierda para R.
Variables de Bienestar
La estimación de las variables de comportamiento, fisiológicas y de desempeño fueron realizadas por el mismo evaluador.
Variables de comportamiento
(a) Latencia para reasumir la alimentación
Se utilizó un tanque de 100 L (61 x 39 x 42 cm, largo, ancho, altura). El lado opuesto y los lados laterales al observador se cubrieron con papel adhesivo azul.
El procedimiento de alimentación se realizó de forma individual, inmediatamente después de tomar las medidas de peso y longitud total, lo cual se hizo cada 15 días hasta completar cinco momentos. Para esto, se colocó el pez en el tanque de prueba con cinco pellets de la misma marca y tamaño del usado en la alimentación diaria. Se evaluó la latencia para reasumir el comportamiento de alimentación después de una situación estresante (Moretz et al., 2007; Martins et al., 2011a). La latencia para reasumir la alimentación se definió como el tiempo que el pez tarda en capturar el primer pellet. La prueba tuvo una duración de 1200 segundos. Al final de la prueba se cambió la totalidad del agua para evitar que señales químicas interfieran con el comportamiento del siguiente individuo. Los peces fueron evaluados cada 15 días hasta completar cinco mediciones, realizadas visualmente en un horario entre las 08.00 y las 11.00 h.
Variables fisiológicas
(a)Frecuencia ventilatoria
Se realizó 15 días después de finalizada la última evaluación morfométrica en el mismo horario y tanque descrito en la prueba de comportamiento alimenticio. Para esto, el pez fue introducido al tanque de prueba evaluando el tiempo necesario para 20 movimientos operculares o bucales (Calderer, 2001; Silva et al., 2010), con una duración máxima de 60 segundos.
(b) Niveles basales de glucosa
Se tomó una muestra de sangre (0.5 mL) vía punción en la vena caudal. El procedimiento se realizó de forma rápida para generar el mínimo estrés y sin la aplicación de anestésico. La evaluación se realizó 15 días posteriores a la última evaluación morfométrica en ayunas en un horario similar al utilizado en la prueba de comportamiento alimenticio. Los niveles de glucosa en sangre se determinaron con el kit Easy Touch® GCHb.
Variables de desempeño
(a) Ganancia de peso
Se determinó la ganancia de peso según la fórmula GP (g)= PF (g)-PI (g), donde PG (g) es la ganancia de peso en gramos, PF(g) es el peso final en gramos y PI (g) es el peso inicial en gramos. Las evaluaciones se realizaron con una balanza eléctrica OHAUS® con capacidad de 1.5 kg y precisión de 0.01 g.
(b) Longitud total
Se determinó de acuerdo con el criterio de Doria-González (2021), medido desde el extremo anterior de la mandíbula hasta el extremo distal del radio más largo de la aleta caudal, empleando un ictiómetro PENTAIR® de 23 cm.
Análisis Estadístico
Los análisis estadísticos se realizaron utilizando el software R con el entorno de desarrollo integrado RStudio (v. R 4.4.0, RStudio Inc). En todas las pruebas se consideraron diferencias significativas cuando p<0.05. La normalidad y la homogeneidad de varianzas se verificaron mediante la prueba de Shapiro wilk y Levene respectivamente. La latencia para reasumir la alimentación se analizó mediante modelos lineales generales considerando los fenotipos, momentos e interacciones como efectos fijos. Las comparaciones múltiples entre los momentos fueron evaluadas con la prueba de Bonferroni.
Las mediciones repetidas de comportamiento se utilizaron para evaluar los cambios individuales en el tiempo, mediante la realización de un modelo de regresión lineal para cada animal. Los coeficientes de regresión (b) se utilizaron además como medida individual para clasificar los peces como habituados (coeficientes b negativos), neutrales (coeficientes b iguales a cero) o sensibilizados (coeficientes b positivos), conforme descrito previamente (Paranhos da Costa et al., 2021).
Los valores basales de glucosa y la frecuencia ventilatoria fueron analizadas a través de la prueba de t de Student. La ganancia de peso fue evaluada con la prueba no paramétrica de Mann-Whitney.
RESULTADOS
Latencia para reasumir la alimentación
La latencia para reasumir la alimentación mostró diferencias significativas entre los tratamientos (p<0.001; Figura 1a) y entre los momentos (p<0.001; Figura 1b), pero no por la interacción fenotipo de comportamiento y momento de evaluación – cada 15 días (p>0.05).
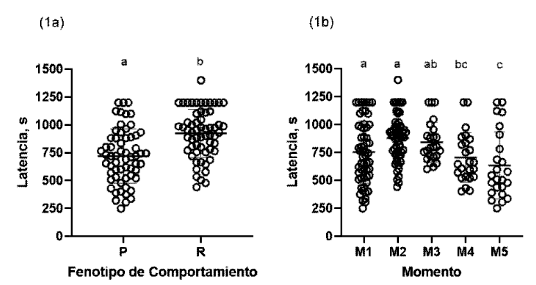
Figura 1. Media ± DE de la latencia para reasumir la alimentación después de una situación estresante (1a) de los tratamientos (P = proactivo, R = reactivo; y momento (1b) en los momentos M1 hasta M5. El símbolo ° indica la variación individual y letras diferentes indican diferencia significativa entre tratamientos y entre momentos (p<0.05)
En los peces P ~92% se habituaron (11 de 12, Figura 2a) y 7 de 12 (~58%) fueron consistentes en sus respuestas R2>0.80; p<0.05. Por otro lado, 75% los peces R se habituaron (9 de 12, Figura 2b), de estos 3 de 12 (~33%) fueron consistentes en sus respuestas R2>0.80; p<0.05.
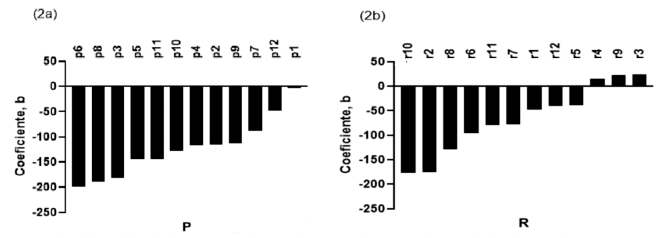
Figura 2. Distribución de los coeficientes b en orden creciente de la latencia para reasumir la alimentación después de una situación estresante. (2a) P= proactivo (2b) R= reactivo en los cinco momentos (cada 15 días)
Frecuencia ventilatoria
Los fenotipos de comportamiento no fueron significativamente diferentes en la frecuencia ventilatoria (p>0.05).
Niveles basales de glucosa
Los niveles basales de glucosa fueron influenciados por el fenotipo de comportamiento (p<0.001, Figura 3).

Figura 3. Media ± DE de los niveles basales de glucosa de los tratamientos (P = proactivo, R = reactivo). El símbolo ° indica la variación individual y letras diferentes indican una diferencia entre los tratamientos (p<0.05)
Ganancia de peso
Los peces P mostraron una mayor y significativa ganancia de peso que los peces R (p<0.01, Figura 4).
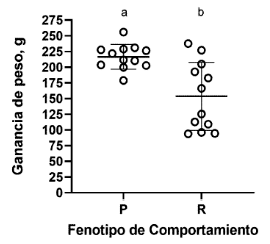
Figura 4. Media ± DE de la ganancia de peso de los tratamientos (P = proactivo, R = reactivo). El símbolo ° indica la variación individual y letras diferentes indican una diferencia entre los tratamientos (p<0.05)
No se encontraron diferencias significativas entre los fenotipos de comportamiento en la longitud total (p>0.05).
Longitud total
No se encontraron diferencias significativas entre los fenotipos de comportamiento en la longitud total (p>0.05).
DISCUSIÓN
Latencia para reasumir la alimentación
La latencia para reasumir la alimentación fue diferente entre los fenotipos de personalidad animal y entre los momentos evaluados. En el caso de los peces proactivos que mostraron menores latencias puede estar relacionado con la alta motivación para alimentarse después de ser transferidos a un nuevo ambiente (Øverli et al., 2007).Asimismo, a pesar de los esfuerzos por estandarizar las condiciones ambientales y horarios de evaluación, el mayor tiempo observado en individuos reactivos para reasumir la alimentación podría estar asociado a la plasticidad que muestra este fenotipo siendo más perceptivo a pequeñas variaciones propias del ensayo o cambios ambientales (Ruiz-Gomez et al., 2011).
Estos hallazgos son importantes considerando que la alimentación representa el mayor porcentaje de los costos de producción y en donde la selección por fenotipos de comportamiento puede mejorar la ingesta y eficiencia de utilización de los piensos y reducir la producción de residuos asociados al alimento no consumido. En este sentido, Martins et al. (2011b) indicaron que las diferencias en la ingesta de alimento en tilapias del Nilo alimentados ad libitum en aislamiento podrían explicar el 81% de las diferencias en crecimiento. De igual forma, Barreto y Volpato (2011) indican que individuos con estilos de afrontamiento proactivo se alimentan más rápido después de un periodo de aislamiento.
Las diferencias motivacionales para reanudar la alimentación después de una situación estresante pueden estar asociadas a patrones metabólicos diferenciales entre proactivos y reactivos. Skov et al. (2019) en un estudio con larvas de trucha arcoíris (Oncorhynchus mykiss), separadas en fenotipos de comportamiento por el tiempo de eclosión, observaron que individuos proactivos presentaban tasas metabólicas rutinarias más altas, lo que sugiere que estos peces necesitan procesar más alimento. Además, indicaron que las tasas metabólicas de rutina se asocian con el costo metabólico de la actividad voluntaria, lo que puede reflejar el costo metabólico de la personalidad.
En este experimento, más del 80% de los peces de ambos fenotipos se habituaron en la prueba de alimentación; sin embargo, es importante tomar en cuenta las diferencias entre fenotipos, ya que los peces proactivos se habituaron en más del 90%, mientras que los reactivos en un 75%. Estas diferencias pueden ayudar a gestionar mejor la producción acuícola, seleccionando fenotipos que, tras situaciones estresantes, reasuman la alimentación más rápido incrementando la rentabilidad y manteniendo la sostenibilidad de la actividad.
Otro aspecto importante es la variación individual en las respuestas de comportamiento, fenómeno que se ha documentado en peces (Budaev et al., 2015). En el estudio, los tratamientos mostraron variación individual en la habitación, donde siete de los peces proactivos y tres de los reactivos redujeron sus respuestas consistentemente durante el tiempo de evaluación. Este resultado destaca la relevancia de considerar la variación individual para mejorar indicadores de bienestar animal, ya que del 80% de los peces que se habituaron, solo 42% redujeron consistentemente la repuesta en el tiempo.
Las implicaciones de la variación individual se han reportado en otras especies. Por ejemplo, Paranhos da Costa et al. (2021), en un estudio con novillas F1 Holstein-Gyr indicaron que la habituación durante el proceso de entrenamiento a la sala de ordeño redujo el miedo, pero que las diferencias individuales juegan un papel importante en los resultados observados. En línea con estos resultados, Creamer y Horback (2024) en un estudio con vacas reproductoras Angus x Hereford indicaron que las diferencias individuales consistentes pueden ser un método apropiado para evaluar temperamento y que pueden mejorar el bienestar animal.
Indicadores fisiológicos
Los fenotipos de comportamiento no fueron diferentes en su frecuencia respiratoria, probablemente porque la mayor reactividad del sistema simpático está asociada a una respuesta al estrés (Priede, 1985; Bell et al., 2010) y en el presente caso se tomaron valores basales. No obstante, los fenotipos de comportamiento mostraron diferencias en las concentraciones sanguíneas de glucosa, con niveles inferiores en los peces proactivos comparados con los reactivos. La mayor concentración de glucosa en sangre en los reactivos puede estar relacionada con la liberación de cortisol que favorece la gluconeogénesis hepática (Marik y Bellomo, 2013). Respuestas similares se han reportado en peces separados en fenotipos de comportamiento proactivo y reactivo en Cyprinus carpio (Rey et al., 2016), Sparus aurata (Vargas et al., 2018), Mugil cephalus (Linares-Cordova et al., 2024).
Indicadores de desempeño
Se observó que los peces proactivos tuvieron mejor ganancia de peso que los reactivos, a pesar de que el peso inicial fue similar entre ambos fenotipos. Este resultado puede estar relacionado con las características de comportamiento que muestran los proactivos con tiempos de recobro más cortos después de una situación estresante reasumiendo la alimentación más rápido. Se ha demostrado que la ingesta de alimento está relacionada con la variación mostrada en el crecimiento (Umino et al., 1997).
Este resultado puede ser apoyado por los hallazgos del estudio de Mas-Muñoz et al. (2011) con Solea solea, reportando que peces audaces en un entorno nuevo y aumento repentino de la intensidad de la luz mostraron alta ingesta de alimento y crecimiento. En esta misma línea en un estudio con Colossoma macropomum en dos fases,Paranhos et al. (2024), en un sistema de recirculación reportaron que en la segunda fase los peces proactivos mostraron un mayor aumento de peso que los reactivos.
CONCLUSIÓN
Los peces proactivos reasumieron la alimentación más rápido, mostraron valores basales de glucosa más bajos y ganaron más peso durante el estudio. Además, un mayor porcentaje de proactivos redujeron consistentemente sus latencias para alimentarse en el tiempo. Estos hallazgos indican que la selección por fenotipos de personalidad animal puede mejorar el bienestar, rentabilidad y sostenibilidad de las granjas acuícolas.



