
Grupo de Investigación en Sanidad Acuícola, Inocuidad y Salud Ambiental, Facultad de Acuicultura y Ciencias del Mar, Universidad Técnica de Manabí, Ecuador y de la Escuela de Posgrado, Universidad Nacional Agraria la Molina, Lima, Perú. http://orcid.org/0000-0002-5451-3990
Grupo de Investigación en Biodiversidad y Ecología de Sistema Acuáticos, Facultad de Acuicultura y Ciencias del Mar, Universidad Técnica de Manabí, Ecuador. http://orcid.org/0000-0003-3720-5416
Grupo de Investigación en Sanidad Acuícola, Inocuidad y Salud Ambiental, Facultad de Acuicultura y Ciencias del Mar, Universidad Técnica de Manabí, Ecuador.
Grupo de Investigación en Sanidad Acuícola, Inocuidad y Salud Ambiental, Facultad de Acuicultura y Ciencias del Mar, Universidad Técnica de Manabí, Ecuador.
ABSTRACT
The chame Dormitator latifrons is a symbolic species associated with rural aquaculture in coastal regions of the South American Pacific. Its adaptation to stay alive out of water (anhydrobiosis) for days is beneficial for its storage and transport at room temperature. The aim of the study was to determine the tolerance of chame to anhydrous conditions. Sixty chames were distributed in containers and kept in two climate-controlled environments at 16 and 24 °C for 96 h. Survival, malondialdehyde levels, total proteins and pH in the muscles and lactate dehydrogenase (LDH) activity in the gills were monitored. Additionally, the behaviour of the fish was monitored, as well as the total number of microorganisms with a sensory evaluation. The critical period of survival occurred after 48 h, where the pH decreased, and the MDA levels increased. The number of microorganisms increased in both environments and the sensory evaluation showed a loss of freshness at 24 °C. LDH activity is linked to the activation of anaerobic metabolism and is a sign of gill deterioration. The results of biochemical, microbiological and sensory analyses indicate that the first 48 h of exposure to anhydrobiosis comprise the period of maintenance of the freshness of D. latifrons, which may be key for its post-harvest handling and sale.
Keywords: freshness; temperature; quality; fish; protein
INTRODUCCIÓN
El pez Dormitator latifrons (Richardson, 1844), llamado comúnmente chame, popoyote o pocoyo dormilón, es originario del Pacífico centro oriental, y habita en ecosistemas de manglares, lagunas costeras y zonas estuarinas (Massay et al., 1992; González-Martínez et al., 2020). Su capacidad para tolerar un amplio rango de condiciones ambientales tales como temperatura (10 a 40 °C), salinidad (0 a 40‰) e hipoxia (~0.5 mg de O2/L) permiten una mejor manipulación en cautiverio (Zapata et al., 2019). Además, su cuerpo robusto, alta palatabilidad y bajos costos de producción lo potencian como una especie idónea para la acuicultura (Gómez et al., 2021).
En Ecuador, la producción de chame es considerada incipiente, alcanzado apenas entre 800 a 1000 t/año (FAO, 2022). En este sentido, la información de su manejo a nivel poscosecha es escasa, particularmente la forma de expendio del producto en los mercados, ya que estos peces pueden ser conservados «vivos» fuera del agua (anhidrobiosis) durante varios días (Chang y Navas, 1984), lo cual puede alterar su frescura.
La comercialización del chame involucra desde la captura, transporte, almacenamiento, venta hasta su consumo final. Debido básicamente a razones económicas y a su tolerancia, el chame suele ser transportado dentro de recipientes sin agua hasta los centros de venta; no obstante, esta práctica conlleva a condiciones estresantes asociadas a la exposición aérea, hipoxia, manipulación, incremento de la temperatura corporal, inanición e interacción con otros individuos (Corredor-Castillo et al., 2019). D. latifrons es capaz de mantenerse bajo anhidrobiosis tras ejercer respiración aérea de manera facultativa, usando una protuberancia en la parte frontal de la cabeza que funciona como órgano de intercambio gaseoso, pudiendo reservar gases adicionalmente en la vejiga natatoria (Todd, 1973). Esta adaptación le permite sobrevivir fuera del agua durante 18 a 54 h, dependiendo de la humedad corporal. La tolerancia a la anhidrobiosis puede aumentar la tasa metabólica en estos peces, lo cual infiere un incremento en la producción de especies reactivas del oxígeno (EROs); radicales libres que pueden dañar moléculas fundamentales como los lípidos y proteínas (Bickler y Buck, 2007; Giraud-Billoud et al., 2024).
La frescura y calidad del chame depende principalmente de la temperatura a la cual sea conservado. Este parámetro organoléptico puede ser estimado a través de la evaluación sensorial (apariencia, olor, textura, color y aspecto de sus branquias), número de microorganismos asociados, así como su deterioro a través del incremento en los niveles de malondialdehido (MDA) (García, 2017; Vásquez-Sánchez et al., 2020). Adicionalmente, la actividad de enzimas citosólicas como lactato deshidrogenasa (LDH) se usa comúnmente como marcador de lisis celular y señal de la activación del metabolismo anaeróbico (Morcillo et al., 2016).
El estrés ocasionado bajo condiciones de anhidrobiosis y las temperaturas ambientales durante el transporte pueden conducir a un deterioro acumulativo de la calidad del chame, lo cual puede provocar cambios en su composición bioquímica y microorganismos asociados. En este sentido, el presente trabajo reporta la tolerancia del chame a condiciones de anhidrobiosis y cómo su frescura puede ser alterada.
MATERIALES Y MÉTODOS
Ejemplares
Un total de 60 ejemplares de Dormitator latifrons adultos, de talla comercial (245±23 g de peso y 24±1 cm de longitud anteroposterior) sin distinción de sexo ni estadio reproductivo, fueron recolectados desde el humedal La Segua, ubicado en el Cantón Chone, provincia de Manabí, Ecuador. Los peces fueron transportados humedecidos en cestas plásticas, durante una hora, hasta el laboratorio.
Exposición a Anhidrobiosis
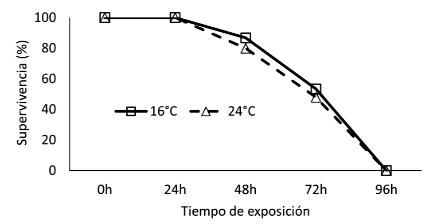
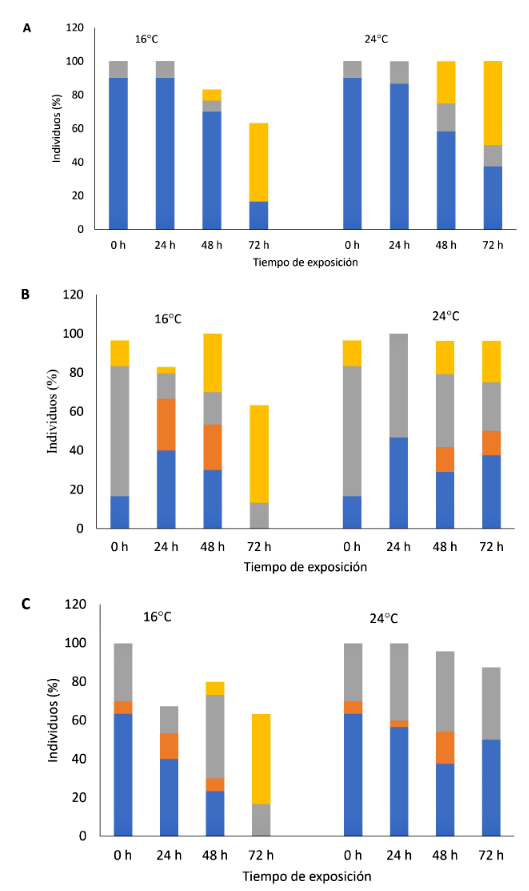
Se distribuyeron 30 peces en cubetas plásticas (25x35x45 cm), 5 chames por cubeta, mantenidos bajo una condición de anhidrobiosis en dos ambientes climatizados (16 y 24 °C), durante 96 h. Diariamente, se registró el comportamiento, movimiento opercular e irritabilidad de los peces (Cuadro 1). Adicionalmente, se estimó la supervivencia y tiempo letal medio (TL50) de tolerancia a la anhidrobiosis.

Los resultados se expresan en promedios ± desviación estándar
Análisis Microbiológicos
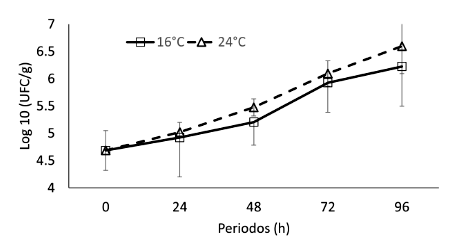
Se observó un incremento en el número de microrganismos en los chames expuestos a anhidrobiosis en los ambientes climatizados durante 96 h, mostrando diferencias significativas entre los días de exposición (F=30.20; p<0.05), más no así entre los tratamientos 16 y24°C(F=2.42;p>0.05).A16 °C se obtuvo una carga microbiana de 4.69 ± 0.36 Log10 UFC/g, que incrementó a 6.23 ± 0.72 Log10 UFC/g luego de 96 h transcurridas. A 24 °C durante 96 h se obtuvo un promedio de 6.60 ± 0.50 Log10 UFC/g, mientras la carga de inicio fue de 4.69 ±0.36 Log10 UFC/g (Figura 3).
Evaluación Sensorial
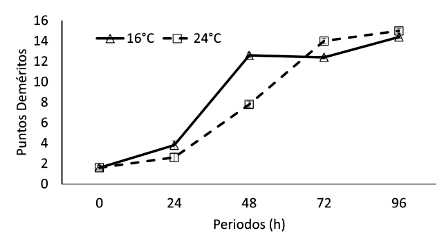
Las puntuaciones de frescura obtenidas de D. latifrons almacenados bajo anhidrobiosis desde las 0 a 96 horas muestran la pérdida progresiva de la frescura en ambas condiciones de almacenamiento, con un incremento mayor, aunque no estadísticamente significativo, en los peces mantenidos a 24 °C (Figura 4). A 16 y 24 °C la evaluación denota una calidad de frescura buena durante 24 h (3 y 4 puntos), mientras que entre 48 y 72 h los peces presentaron una calidad regular de 12 y 8-14 puntos deméritos, respectivamente, siendo considerado el producto de mala calidad a 96 h (14 puntos a 16 °C y 15 puntos a 24 °C). Se obtuvo diferencias significativas en los periodos de exposición (F=49.27; p<0.001).
DISCUSIÓN
Los resultados de los análisis bioquímicos, microbiológicos y sensoriales indican que la frescura del chame D. latifrons bajo exposición a anhidrobiosis puede ser ideal hasta las 48 h. Este periodo crítico para la supervivencia de los chames fuera del agua probablemente se encuentre asociado a una condición de estrés ambiental que provoca el ajuste a la reducida disponibilidad para captar el oxígeno indispensable para los procesos metabólicos. D. latifrons puede sobrevivir fuera del agua por 5 días continuos, habiéndose observado una mortalidad de 50% de los organismos expuestos a hipoxia hasta 18 h (Chang, 1984; Todd, 1973; Vega-Villasante et al., 2021). Se conoce que el consumo de oxígeno es reducido en la mayoría de los organismos tolerante a la anhidrobiosis, lo que conlleva a una condición hipometabólica y comportamiento aletargado (Lefevre et al., 2014). Se presume que la capacidad de respiración aérea facultativa de D. latifrons podría estar relacionada con adaptaciones específicas que le permiten afrontar condiciones extremas como la anhidrobiosis. Estudios más específicos podrían identificar adaptaciones bioquímicas y mecanismos fisiológicos de ajustes durante la anhidrobiosis, particularmente la composición de su piel y su relación con la pérdida de agua excesiva durante esta condición.
El comportamiento de los peces bajo anhidrobiosis fue considerado normal hasta las 48 h, para luego deprimirse a las 72 h, con movimientos operculares disminuidos, movimientos corporales intermitentes y poca sensibilidad, posiblemente destinados a para preservar la energía y activar los mecanismos de respiración aérea para incrementar la captación de oxígeno (Kramer, 1987). Agualsaca (2015) menciona que el chame, al soportar concentraciones bajas de oxígeno desde 0.5 ppm, sus branquias no colapsan cuando están fuera del agua, se mantienen húmedas y el intercambio gaseoso puede ser cutáneo. Esta adaptación le permite al chame vivir fuera del agua en ambiente húmedo de tres a cinco días asociado a una disminución de su tasa metabólica para reducir sus requerimientos de oxígeno y preservar la energía en condiciones de anoxia (Van Waversveld et al., 1989).
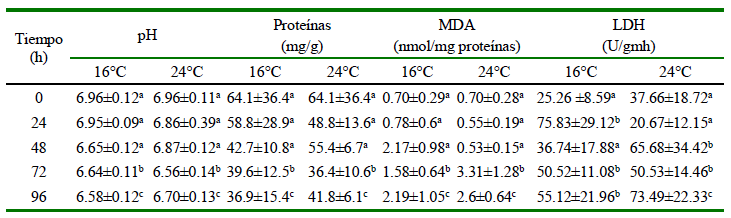
La caída del pH en el músculo puede estar relacionado a una alteración ácido-base debido principalmente a la producción metabólica de H+ a través de la síntesis de lactato (Pelster et al., 1988), inclusive ayudado por el posible incremento de bacterias ácido-lácticas favorecidas frente a las aerobias estrictas (Ayala et al., 2010). La musculatura de los peces recién sacrificados tiene un pH cercano a la neutralidad y a partir de este momento, la ausencia de oxígeno origina la glucólisis anaerobia y la acumulación de compuestos ácidos, lo que conlleva a la disminución del pH (Santaella-Pascual, 2015).
El porcentaje de proteína obtuvo un decrecimiento en los dos tratamientos; no obstante, el resultado fue más bajo a los 16 °C, del cual se refleja que a menor temperatura mayor degradación de proteína (Moreira-López, 2022). Adicionalmente, los valores de MDA incrementaron con el tiempo de exposición a anhidrobiosis. Piedrahita et al. (2015) determinaron que la oxidación lipídica en muestras de filetes de pescados de cachama (Piaractus brachypomus), bocachico (Prochilodus magdalenae) y tilapia (Oreochromis niloticus) durante 0, 4, 8, 12, 16 y 20 h expuestos a 30 °C resultó en valores mayores a 1 mg MDA/kg a partir del cuatro día de almacenamiento. No obstante, el pescado de este estudio todavía puede ser consumido ya que los valores de MDA son inferiores a 5 nmol TBARS/mg (Jouki et al., 2014).
La actividad de las enzimas LDH da referencia a la capacidad en el metabolismo anaeróbico que posee D. latifrons para tolerar los cambios ambientales en el ecosistema donde habita. El pez en condiciones fuera del agua es conducido a cambios metabólicos anaeróbicos incrementando la actividad LDH con la generación continua de energía bajo condiciones anaeróbicas provocada por una hipoxia inducida (Farhana y Lappin, 2024). Se ha considerado que la pérdida de la integridad de la membrana celular bajo procesos de apoptosis, necrosis u otras formas de deterioro pueden ser a causa de la liberación del LDH, llevando a consecuencias negativas en la salud del pez (Chan et al., 2013, Kamiloglu et al., 2020).
La carga de aerobios mesófilos al final de bioensayo sugiere que sobrepasa los requisitos de la norma NTE INEN (1896: 2013). Se considera que las temperaturas de 16 y 24 °C ayudan a mantener inhibido el crecimiento microbiano, ya que los aerobios mesófilos se desarrollan en presencia de oxígeno libre y a una temperatura comprendida entre 15 y 45 °C, siendo el rango óptimo entre 30 y 40 °C (Cáceres, 2018; Álvarez, 2021).
Con respecto a la evaluación sensorial, la puntuación de apariencia incrementó con el tiempo de exposición, lo que indica una pérdida progresiva de frescura en las dos temperaturas en estudio. Resultados similares fueron obtenidos por Özogul et al. (2005) en Anguilla anguilla almacenada en dos ambientes (con hielo y sin hielo) y en contraste con Burghi Echeverriarza et al. (2015) donde Oreochromis niloticus alcanzó el mayor nivel de frescura no apto para consumo hasta el día 16, en cámaras de 0-5 °C.
CONCLUSIONES
La frescura del pescado Dormitator latifrons expuesto a anhidrobiosis bajo dos ambientes climatizados (16 y 24 °C) fue conservada hasta las 48 h.
La actividad de lactato deshidrogenasa (LDH) en branquias se incrementó asociada a los periodos de anhidrobiosis y temperaturas, lo cual vincula la activación del metabolismo anaeróbico.
Las bacterias mesófilas incrementaron y el número de microorganismos aerobios se duplicó para ambos ambientes.
El 50% de la supervivencia fue alcanzado a las 48 h en anhidrobiosis para ambas temperaturas y una máxima tolerancia hasta 72 h.
La evaluación sensorial demuestra que a las 48 h se evidencia el deterioro la calidad organoléptica del chame cuando es mantenido «fuera del agua», teniendo una interacción directa con la temperatura ambiental de mantenimiento.
LITERATURA CITADA
1. Abaroa MC, Pérez Villareal B, González de Zárate A, Boitiz X, Bald C, Riesco S, Picaza N. 2008. Frescura del pescado: Guía visual para la evaluación sensorial. Azti Tecnalia; 69 p. [ Links ]
2. Agualsaca-Ormaza JG. 2015. Adaptación de chame (Dormitator latifrons) sometido a cautiverio utilizando cuatro niveles de detritus y balanceado en su alimentación. Tesis de Pregrado. Santo Domingo, Ecuador: Universidad de las Fuerzas Armadas ESPE. 91 p. [ Links ]
3. Álvarez T. 2021. Efectos de la congelación y ultracongelación en la estructura y textura de frutas y vegetales: Una revisión bibliográfica de datos publicados. Tesis de Pregrado. Ambato, Ecuador: Universidad Técnica de Ambato. 58 p. [ Links ]
4. Ayala MD, Abdel I, Santaella M, Martínez C, Periago MJ, Gil F, Blanco A, Albors OL. 2010. Muscle tissue structural changes and texture development in sea bream, Sparus aurata L., during post-mortem storage. LWT -Food Sci Technol 43: 465-475. doi: 10.1016/j.lwt.2009.08.023. [ Links ]
5. Bickler PE, Buck LT. 2007. Hypoxia tolerance in reptiles, amphibians, and fishes: life with variable oxygen availability. Annu Rev Physiology 69: 145-170. doi: 10.1146/annurev.physiol.69.031905.162529. [ Links ]
6. Burghi-Echeverriarza JM, Montero Velázquez GI. 2015. Evaluación sensorial de la frescura en tilapia (Oreochromis niloticus). Tesis Doctoral. Montevideo, Uruguay: Universidad de la República. 30 p. [ Links ]
7. Cáceres M. 2018. Determinación de la calidad microbiológica de cosméticos capilares elaborados a base de compuestos naturales comercializados en Lima Metropolitana. Tesis de Pregrado. Lima, Perú: Universidad Ricardo Palma. 70 p. [ Links ]
8. Chang BD, Navas W. 1984. Seasonal variations in growth, condition and gonads of Dormitator latifrons (Richardson) in the Chone River Basin, Ecuador. J Fish Biol 24: 637-648. doi: 10.1111/j.10958649.1984.tb04834.x. [ Links ]
9. Corredor-Castillo AS, Landines Parra MÁ. 2019. Respuestas fisiológicas de Piaractus brachypomus suplementado con ácido ascórbico y sometido a estrés por hipoxia. Rev Med Vet 38: 29-40. doi: 10.19052/mv.vol1.iss38.3. [ Links ]
10. Chan FKM, Moriwaki K, De Rosa MJ. 2013. Detection of necrosis by release of lactate dehydrogenase activity. Methods Mol Biol 2013:979:65-70. doi: 10.1007/978-1-62703-290-2_7. [ Links ]
11. Chang BD. 1984. Tolerances to salinity and air exposure of Dormitator latifrons (Pisces: Eleotridae). Rev Biol Trop 32: 155-157. [ Links ]
12. [FAO] Organización de las Naciones Unidas para la Agricultura y la Alimentación. 2020. El estado mundial de la pesca y la acuicultura. Roma, Italia: FAO. 274 p. doi: 10.4060/cc0461es. [ Links ]
13. Farhana A, Lappin SL. 2024. Biochemistry, lactate dehydrogenase. 2023 May 1. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; Jan. PMID: 32491468. [ Links ]
14. García RC. 2017. Acondicionado del pescado y marisco. INAJ0109. IC Editorial. 268 p. [ Links ]
15. Gómez JRJ, Sánchez EJS, De la Cruz Chicaiza M, Jácome-Gómez LR, Martínez-Sotelo MC. 2021. Caracterización productiva del chame (Dormitator latifrons) bajo tratamientos de siembras sexados. Dominio de las Ciencias 7: 856-869. doi: 10.23857/dc.v7i5.2286. [ Links ]
16. González-Martínez A, López M, Molero HM, Rodríguez J, González M, Barba C, García A. 2020. Morphometric and meristic characterization of native chame fish (Dormitator latifrons) in Ecuador using multivariate analysis. Animals 10: 1805. doi: 10.3390/ani10101805. [ Links ]
17. Gornall AG, Bardawill CI, David MM. 1949. Determination of serum proteins by means of the Biuret reaction. J Biol Chem 177: 751-766. doi: 10.1016/S0021-9258(18)57021-6. [ Links ]
18. Giraud-Billoud M, Moreira DC, Minari M, Andreyeva A, Campos EG, Carvajalino-Fernández JM, Istomina A, et al. 2024. Review: evidence supporting the ‘preparation for oxidative stress’ (POS) strategy in animals in their natural environment. Comp Biochem Physiol A Mol Integr Physiol 293:111626. doi: 10.1016/j.cbpa.2024.111626. [ Links ]
19. [INEN] Instituto Nacional Ecuatoriano de Normalización. 2013. Pescados frescos refrigerados o congelados de producción acuícola. Requisitos. Quito: Instituto Nacional Ecuatoriano de Normalización. NTE INEN 1896:2013 Primera revisión. [Internet]. Disponible en: https://1library.co/document/q2g58wpypescado-fresco-refrigerado-y-congelado-requisitos.html. [ Links ]
20. International Standards Organization (ISO 2017:1999). Meat and meat products – Measurement of pH -Reference method. Geneva, Switzerland: The International Organization for Standardization. [ Links ]
21. Jouki M, Yazdi F, Mortazavi S, Koocheki A, Khazaei N. 2014. Effect of quince seed mucilage edible films incorporated with oregano or thyme essential oil on shelf-life extension of refrigerated rainbow trout fillets. Int J Food Microbiol 174: 88-97. doi: 10.1016/j.ijfoodmicro.2014.01.001. [ Links ]
22. Kamiloglu S, Sari G, Ozdal T, Çapanoðlu Güven E. 2020. Guidelines for cell viability assays. Food Frontiers 1: 332-349. doi: 10.1002/fft2.44. [ Links ]
23. Kramer DL. 1987. Dissolved oxygen and fish behavior. Environ Biol Fishes 18: 81-92. doi: 10.1007/bf00002597. [ Links ]
24. Lefevre S, Wang T, Jensen A, Cong NV, Huong DTT, Phuong NT, Bayley M. 2014. Air-breathing fishes in aquaculture. What can we learn from physiology? J Fish Biol 84: 705-731. doi: 10.1111/jfb.12302. [ Links ]
25. Livingstone DR, Stickle WB, Kapper MA, Wang S, Zurburg W. 1990. Further studies on the phylogenetic distribution of pyruvate oxidoreductase activities. Comp Biochem Physiol (B) 97: 661-666. doi: 10.1016/0305-0491(90)90104-2. [ Links ]
26. Massay S, Mosquera R. 1992. Presence of chame Dormitator latifrom (Richardson, 1844) (Pisces: Eleotridae), in the Galapagos Islands, Ecuador. J Fish Biol 40: 815-816. doi: 10.1111/j.10958649.1992.tb02627.x. [ Links ]
27. Moreira-López JJ. 2022. Incidencia del tiempo y temperatura de almacenamiento en la calidad microbiológica y estabilidad de la textura en carne dechame (Dormitator latifrons). Tesis de Maestría. Calceta, Ecuador: Escuela Superior Politécnica Agropecuaria de Manabí. 57 p. [ Links ]
28. Morcillo P, Esteban M, Cuesta A. 2016. Heavy metals produce toxicity, oxidative stress and apoptosis in the marine teleost fish SAF-1 cell line. Chemosphere 144: 225-233. [ Links ]
29. Ohkawa H, Ohishi N, Yaki K. 1979. Assays for lipid peroxides in animal tissue by thiobarbituric acid reaction. Anal Biochem 95: 331-358. doi: 10.1016/00032697(79)90738-3. [ Links ]
30. Özogul Y, Özyurt G, Özogul F, Kuley E, Polat A. 2005. Freshness assessment of European eel (Anguilla anguilla) by sensory, chemical and microbiological methods. Food Chemistry 92: 745-751. doi: 10.1016/j.foodchem.2004.08.035. [ Links ]
31. Pelster B, Bridges CR, Grieshaber MK. 1988. Physiological adaptations of the intertidal rockpool teleost Blennius pholis L., to aerial exposure. Resp Physiol 71: 355-373. [ Links ]
32. Piedrahita-Márquez DG, Suárez Mahecha H, Vargas-López JH. 2015. Control de la oxidación lipídica en filetes de pescado utilizando recubrimientos comestibles a base de aceite de naranja. Uso de biomoléculas en películas comestibles y desarrollo de nuevos productos para la generación de valor y competitividad. Tesis de Maestría. Palmira, Colombia. Universidad Nacional de Colombia. 95 p. [ Links ]
33. Santaella-Pascual M. 2015. Nuevas presentaciones comerciales de dorada (Sparus aurata L.) de acuicultura: evaluación de la calidad y seguridad alimentaria. Tesis Doctoral. Murcia, España: Universidad de Murcia. 120 p. [ Links ]
34. Sneddon LU. 2012. Clinical anesthesia and analgesia in fish. J Exotic Pet Med 21: 32-43. doi: 10.1053/j.jepm.2011.11.009. [ Links ]
35. Todd ES. 1973. Positive buoyancy and air-breathing: a new piscine gas bladder function. Copeia 3: 461-464. doi: 10.2307/1443110. [ Links ]
36. Van Waversveld J, Addink ADF, Van den Thillart GE. 1989. The anaerobic energy metabolism of goldfish determined by simultaneous direct and indirect calorimetry during anoxia and hypoxia. J Comp Physiol B 159: 263-268. doi: 10.1007/BF00691503. [ Links ]
37. Vásquez-Sánchez D, García EES, Galvão JA. 2020. Quality index method (QIM) scheme developed for whole Nile tilapias (Oreochromis niloticus) ice stored under refrigeration and correlation with physicochemical and microbiological quality parameters. J Aquatic Food Prod Technol 29: 307-319. doi: 10.1080/10498850.2020.1724222. [ Links ]
38. Vega-Villasante F, Ruiz-González LE, Chong-Carrillo O, Basto-Rosales MER, Palma-Cancino DJ, Tintos-Gómez A, Montoya-Martínez CE, et al. 2021. Biology and use of the Pacific fat sleeper Dormitator latifrons (Richardson, 1844): state of the art review. Latin Am J Aquatic Res 49: 391-403. doi: 10.3856/vol49-issue3-fulltext-2637. [ Links ]
39. Zapata AA, Vega-Villasante F, Chong-Carrillo O. 2019. Effect of salinity on the gill ventilation frequency of Dormitator latifrons (Richardson, 1984). Ecosistemas y Recursos Agropecuarios 6: 601-607. doi: 10.19136/era.a6n18.2179. [ Links ]
Recibido: 10 de Junio de 2024; Aprobado: 04 de Enero de 2025
* Autor correspondiente: Alexandra Bermúdez-Medranda; alexandra.bermudez@utm.edu.ec

Decano: Dr. Fernando Carcelén Cáceres
Vicedecano Académico y de pregrado: Dr. Alexei Vicent Santiani Acosta
Vicedecano de Investigación y Posgrado: Dr. Raúl Héctor Rosadio Alcántara
Copyright ©2025 Todos los Derechos Reservados
Desarrollado por Unidad de Estadística e Informática de la Facultad de Medicina Veterinaria de la UNMSM
