
RESUMEN
La cotorra argentina (Myiopsitta monachus) es una especie invasora de alto riesgo a nivel mundial, por lo que la introducción de sus agentes patógenos aumenta el riesgo de infección y transmisión en especies nativas. El objetivo de este trabajo fue recopilar información de documentos publicados entre 2000 y 2021 sobre la presencia de ecto-y endoparásitos de interés veterinario y de salud pública reportadas en M. monachus. Se registraron 13 documentos publicados (11 artículos científicos y dos de literatura gris), en los que se reportan 17 especies de parásitos (11 ectoparásitos y seis endoparásitos). Los ectoparásitos presentaron una mayor prevalencia (27.2 ± 30.8%) que los endoparásitos (16.0 ± 15.2%). La prevalencia de ectoparásitos y endoparásitos no estuvo influenciada por las condiciones ambientales (Ectoparásitos: humedad relativa: p>0.05; temperatura: p>0.05; Endoparásitos: humedad relativa: p>0.05; temperatura: p>0.05).Aunque no hubo diferencias significativas para cada tipo de hábitat (bosque templado: p>0.05; matorral: p>0.05), es de gran importancia sensibilizar y desarrollar estrategias de control de las especies invasoras, ya que suponen una amenaza para la salud animal y humana; sin embargo, la falta de información sobre las enfermedades que pueden presentar estas especies es un obstáculo para comprender los riesgos que conllevan. Este estudio demostró que existen pocos reportes de agentes parasitarios que involucren a M. monachus.
Palabras clave: ectoparásitos; endoparásitos; factores ambientales; prevalencia
Facultad de Medicina Veterinaria y Zootecnia, Universidad Popular Autónoma del Estado de Puebla, Puebla, México.
Facultad de Medicina Veterinaria y Zootecnia, Universidad Popular Autónoma del Estado de Puebla, Puebla, México.
Instituto de Ecología, A.C., Secretaría Técnica, Xalapa, Veracruz, México
In vitro models for the development of sustainable aquaculture. The application of the cell line model
ABSTRACT
The monk parakeet (Myiopsitta monachus) is a high-risk invasive species worldwide, so the introduction of its pathogens increases the risk of infection and transmission in native species. The aim of this work was to collect information from documents published between 2000 and 2021 on the presence of ecto-and endoparasites of veterinary and public health interest reported in M. monachus. Only 13 documents were recorded (11 scientific articles and two from the grey literature), in which 17 species of parasites are reported (11 ectoparasites and six endoparasites). Ectoparasites had a higher prevalence (27.2 ± 30.8%) than endoparasites (16.0 ± 15.2%). The prevalence of ectoparasites and endoparasites was not influenced by environmental conditions (Ectoparasites: relative humidity: p>0.05; temperature: p>0.05; Endoparasites: relative humidity:p>0.05;temperature:p>0.05).Althoughtherewerenosignificant differences for each habitat type (temperate forest: p>0.05; scrubland: p>0.05), it is of great importance to raise awareness and develop control strategies for invasive species, since they pose a threat to animal and human health; however, the lack of information on the diseases that these species can present is an obstacle to understanding the risks they entail. This study showed that there are few reports of parasitic agents involving M. monachus.
Keywords: ectoparasites; endoparasites; environmental factors; prevalence
INTRODUCCIÓN
La cotorra argentina (Myiopsitta monachus) o perico monje se distribuye en Argentina, Bolivia, Brasil, Paraguay y Uruguay, y es considerada una especie invasora de alto riesgo en varias partes del mundo, probablemente debido a liberaciones y escapes accidentales (MacGregor-Fors et al., 2011; Rodríguez-Maturino et al., 2018). Con la prohibición del comercio de psitácidas nativas en México en 2008, el comercio ilegal de esta especie aumentó, siendo muchos individuos comercializados de origen silvestre (Hobson et al., 2017). Se ha reportado que, en la Ciudad de México, las psitácidas como mascotas no convencionales, son llevadas a atención veterinaria en poco más del 77% de los pacientes aviares, siendo la cotorra argentina la tercera especie de psitácido en ser atendida (Ángeles-Torres et al., 2023).
La cotorra argentina puede causar importantes daños económicos al sector agrícola ya la infraestructura eléctrica (MacGregor-Forsetal.,2011; Tinajero y Rodríguez-Estrella, 2015; Appelt et al., 2016), así como causar daños ecológicos al presentar una fuerte competencia hacia otras aves. Al igual que muchas especies invasoras, estas aves pueden actuar como vector potencial y/o reservorio de transmisión de enfermedades, introduciendo nuevos patógenos o facilitando la dispersión de patógenos nativos (Briceño et al., 2019).
En esta especie se han reportado enfermedades infecciosas como el virus de Newcastle o zoonosis como la psitacosis (Hobson et al., 2017), así como la presencia de ectoparásitos como Ornithonyssus bursa (Briceño et al., 2017; Evangelho-Silva et al., 2018) y endoparásitos como Cryptosporidium sp. (Sandoval-Rodríguez et al., 2021). Con base en la importancia de los riesgos de la cotorra argentina como especie exótica invasora, el objetivo de este trabajo fue recopilar información de documentos publicados entre 2000 y 2021 sobre la presencia de especies de parásitos externos e internos de interés veterinario y de salud pública reportadas en Myiopsitta monachus bajo cuidado humano (zoológicos y mascotas), poblaciones silvestres y ferales.
MATERIALES Y MÉTODOS
Recopilación de Datos
Una búsqueda exhaustiva de artículos científicos y literatura gris que reportan parásitos en la cotorra argentina se realizó con los buscadores académicos Web of Science, Springer Link, Google Academic, Academia, Redalyc Scientific Information System, SciELO (Scientific Electronic Library Online), Dialnet (Dissemination of Alerts on the Network) y ERIC (Education Resources Information Center). La búsqueda de información consideró documentos publicados entre 2000 y 2021 y las palabras clave Myiopsitta monachus, cotorra argentina, perico monje, «Monk parakeet», «parasites», parásitos y «parasite diseases».
Publicaciones de literatura gris que correspondían a informes de proyectos que no estaban avalados por una institución de investigación, universidad o agencia gubernamental, los documentos que se identificaron como de versión de artículo científico y los documentos que no incluían los datos completos necesarios para el análisis fueron excluidos. Los datos requeridos incluyeron la localidad, el país, el tipo de parásito (ecto-o endoparásito), la especie de parásito, la prevalencia e intensidad, y los riesgos para otras especies o riesgos para la salud pública, así como la información climática (temperatura y humedad relativa) y el hábitat (tipo de vegetación) donde se realizaron los hallazgos.
Análisis Estadístico
Para las referencias científicas y de la literatura gris contabilizadas se realizó estadística descriptiva (promedio y desviación estándar) de los datos epidemiológicos (prevalencia e intensidad parasitaria). Para verificar las diferencias entre la prevalencia por tipo de parásito (endo-y ectoparásito) se realizó un análisis de varianza (ANOVA). Además, se realizó un análisis de correlación para reconocer si las condiciones ambientales (temperatura y humedad) influyen en los parámetros epidemiológicos. También, se realizó un análisis factorial de varianza para detectar diferencias en los parámetros epidemiológicos por tipo de parásito y por tipo de hábitat donde las cotorras argentinas fueron estudiadas.
RESULTADOS
En la exploración de la información en los ocho buscadores de literatura científica se recopilaron 13 documentos publicados entre 2000 y 2021 (11 artículos científicos y dos de literatura gris). En estas referencias se reportaron 17 especies de parásitos, incluyendo 11 ectoparásitos y seis endoparásitos, pertenecientes a 14 familias. Los parásitos internos estuvieron representados por seis familias, reportadas principalmente en cuatro países (Chile, Italia, España y México). Ascaridia spp. tuvo la mayor prevalencia (50%) y Leucocytozoon spp. la más baja (3.13%) (Cuadro 1). Las infecciones parasitarias externas estuvieron representadas por 11 familias, reportadas principalmente en cinco países (Argentina, Chile, Italia, España y México). La prevalencia más alta fue para Psitticimex uritui (100%) y la más baja para Crataerina pallida y Ornithophila metallica (0.79%) (Cuadro 2).
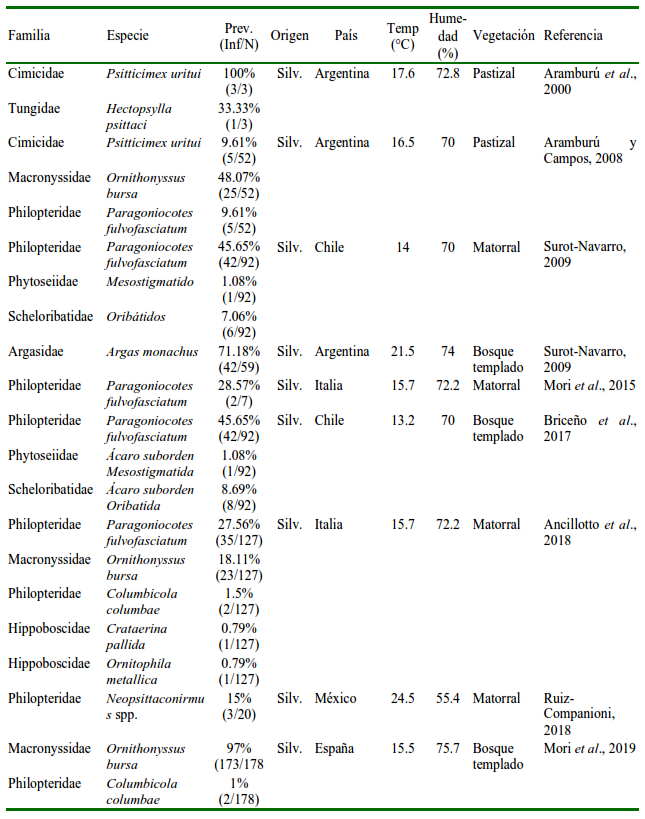
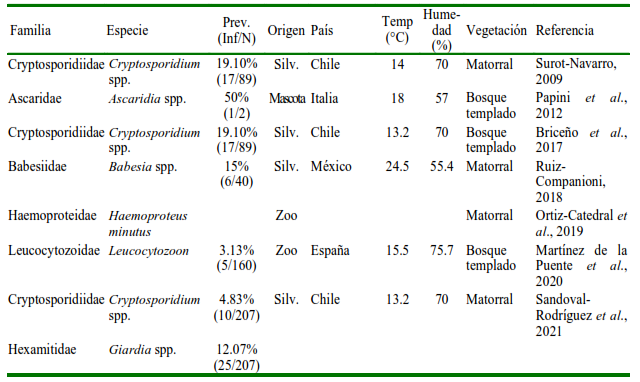
Inf/N= Infectados/número de muestras; Prev= Prevalencia; Silv.= Silvestre; Zoo= Zoológico
Diez de los estudios se realizaron en aves silvestres, mientras que tres estudios se realizaron en aves bajo cuidado humano. De acuerdo con el número de referencias, los parásitos Paragoniocotes fulvofasciatum, Ornithonyssus bursa y Cryptosporidium spp. fueron los que se reportaron con mayor frecuencia (Cuadro 3).
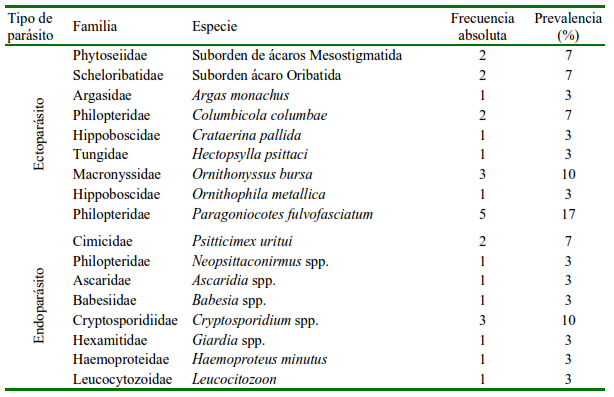
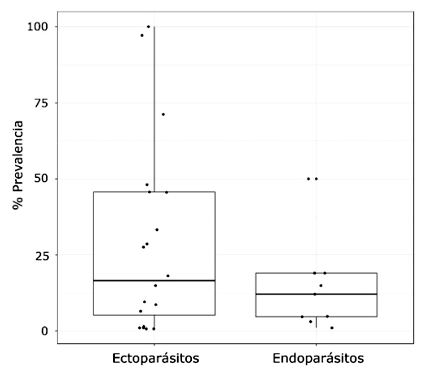
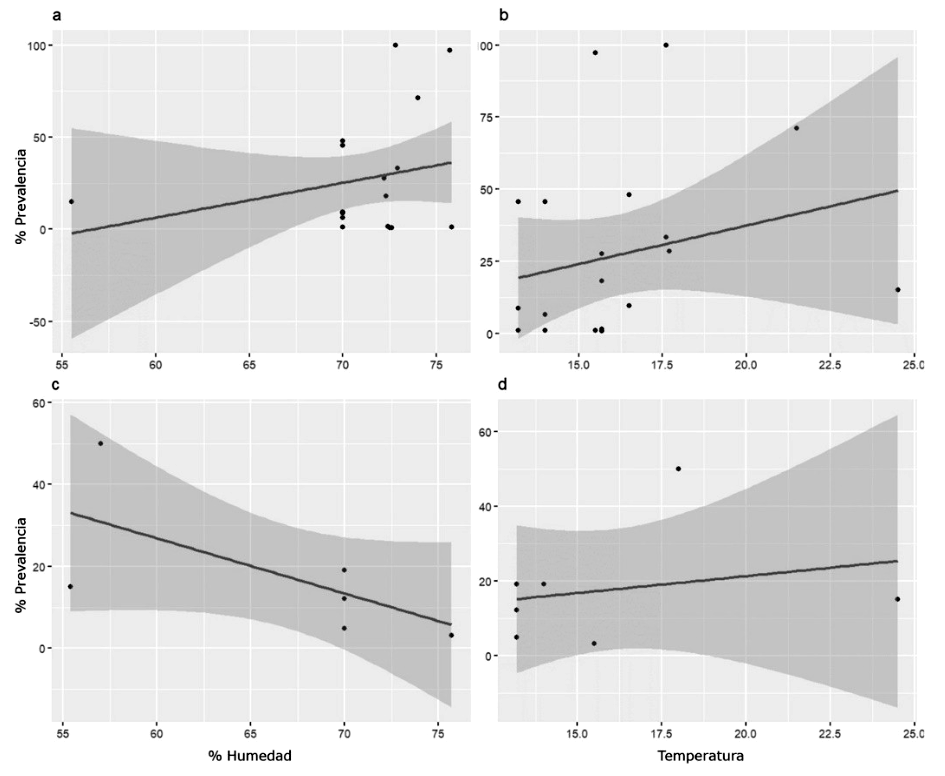
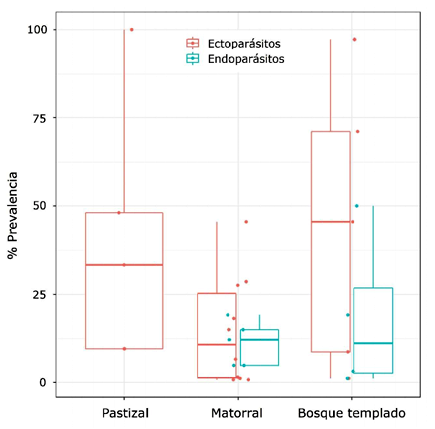
La prevalencia de ecto-y endoparásitos no estuvo influenciada por las condiciones ambientales (Ectoparásitos: humedad relativa: r=0.25, p>0.05; temperatura: r=0.24, p>0.05; Endoparásitos: humedad relativa: r=0.65, p>0.05; temperatura: r=0.24, p>0.05) (Figura 2). La prevalencia de estos parásitos con relación al tipo de hábitat donde se estudiaron las cotorras argentinas muestra que no existen diferencias (p>0.05). Sin embargo, si bien no hubo diferencias significativas para cada tipo de hábitat (bosque templado: p>0.05; matorral: p>0.05), los ectoparásitos fueron los únicos reportados para el pastizal, y la tendencia en la prevalencia de endoparásitos parece ser menor que la de ectoparásitos en hábitats boscosos (Figura 3).
DISCUSIÓN
La cotorra argentina es una especie que ha tenido un gran impacto en los ecosistemas de diversas partes del mundo. Debido a su gran capacidad de adaptación, ha sido catalogada como una especie invasora de alto riesgo en varios países (MacGregor-Fors et al., 2011). Además, pueden afectar a otras especies a través de la agresión y la competencia por el alimento, además dañar la infraestructura urbana debido a la construcción masiva de nidos y daños a los cultivos (Tinajero y Rodríguez-Estrella, 2015).
La cotorra argentina construye nidos comunales en forma de cámaras, que también brindan refugio a múltiples especies, tanto nativas (por ejemplo, Falco sparverius y Curaeus curaeus) como exóticas invasoras (por ejemplo, Columba livia y Passer domesticus) (Briceño et al., 2019). El uso de nidos por diversas especies y las interacciones con diversos individuos favorecen la transmisión de enfermedades, principalmente ectoparásitos como los ácaros, que se transmiten a través del contacto directo entre huéspedes o en nidos infectados (Evangelho-Silva et al. 2018; Briceño et al., 2019).
Existen parásitos, como Ornithonyssus bursa, que son abundantes en los polluelos y nidos de la cotorra argentina, y como son parásitos intermitentes pueden permanecer en los nidos durante largos periodos antes de trasladarse a un nuevo hospedero (Briceño-Urzúa et al., 2021). Este parásito afecta a las aves silvestres y se considera una plaga en las aves de producción, causando anemia y afectando a la producción (Santillán et al., 2015). En la producción avícola de traspatio, los parásitos pueden ser responsables de hasta el 90% de la mortalidad (Cruz et al., 2013), siendo Passer domesticus, Sturnus vulgaris y Columba livia las principales especies responsables de la transmisión de ácaros (por ejemplo, O. sylviarum y O. bursa) a las aves de producción (Atkinson et al., 2008). Aunque O. bursa rara vez afecta a los mamíferos, se han notificado casos de dermatitis en humanos debidos a mordeduras accidentales, cuando se establecen nidos infectados cerca de asentamientos humanos y/o cuando no hay un huésped aviar disponible (Briceño-Urzúa et al., 2021).
La pulga Hectopsylla psittaci infecta a la cotorra argentina silvestre en su área de distribución natural con una prevalencia del 33% (Aramburú et al., 2000). Asimismo, se ha notificado la presencia de este ectoparásito en otras regiones debido a la introducción de especies hospedadoras o a la introducción accidental de especies migratorias (Cerpa et al., 2018).
También se ha reportado un caso de presencia de moscas del piojo, como Ornithophila metallica y Crataerina pallida en la cotorra argentina. Aunque no existen muchos estudios específicos sobre su potencial en la transmisión de zoonosis, en algunas moscas Hippoboscidae se han detectado patógenos como Bartonella spp., Rickettsia spp., Borrelia burgdorferi, Anaplasma phagocytophilum, Trypanosoma y Theileria ovis (Bezerra-Santos y Otranto, 2020). Sin embargo, la especificidad entre los parásitos y sus huéspedes varía, habiéndose reportado casos de transmisión cruzada (Atkinson et al., 2008).
Por ejemplo, Crataerina pallida, a pesar de ser un parásito hematófago específico de Apus apus, se ha reportado transmisión horizontal en colonias donde los nidos están muy juntos, parasitando a Apus pallidus y a la cotorra argentina (Walker y Rotherham, 2010; Ancillotto et al., 2018). Este es el mismo caso de Columbicola columbae, un parásito permanente y específico de Columba livia, que también ha sido reportado en varias especies de aves, incluyendo Myiopsitta monachus (Singh et al., 2010), así como piojos del género Neopsittaconirmus spp., que también han sido reportados en diferentes especies de psitácidos (Sychra, 2006; Wolpertde Gois et al., 2022).
También destacan ectoparásitos específicos de la cotorra argentina, como Paragoniocotes fulvofasciatum, registrados en al menos un tercio de los artículos recogidos (17%), lo que lo convierte en el parásito más reportado de la especie. Este parásito ha sido detectado en otros psitácidas sudamericanos como Brotogeris cyanoptera y la cotorra argentina introducidos en Europa (Gómez-Puerta y Luján-Vega, 2018).
Los piojos masticadores pertenecientes al suborden Ischnocera, como Neopsittaconirmus spp., Columbicola columbae y P. fulvofasciatum, son parásitos permanentes que se alimentan de la queratina de las plumas y los desechos dérmicos y se transmiten de las aves adultas a sus crías (Aramburú et al., 2003). Las infestaciones fuertes pueden causar hiperqueratosis y daños en las plumas hasta el punto de romperse (Girisgin et al., 2013). En la parasitosis extrema, algunas aves pueden abandonar sus nidos o automutilarse las plumas, facilitando la entrada de infecciones secundarias (Wolpert-de Gois et al., 2022). La mayoría de las especies de piojos masticadores son específicas de una especie en particular, pero también pueden parasitar a grupos cercanos (Wolpert-de Gois et al., 2022), lo que supone un riesgo potencial de infestación y/o introducción de estos parásitos de aves silvestres a aves domésticas y viceversa.
Aunque se conocen alrededor de 4000 especies de piojos masticadores, ninguna es capaz de parasitar a los humanos (Girisgin et al., 2013). Psitticimex uritui y Argas monachus son ectoparásitos de la cotorra argentina, con una prevalencia de 7 y 3%, respectivamente (Cuadro 3), siendo A. monachus una de las menos frecuentes. En el caso de P. uritui, aunque su hospedero original es M. monachus, también se ha reportado en Cyanoliseus patagonus y Pseudoseisura lophotes, ambas especies sudamericanas (Aramburú y Campos-Soldini, 2008). Este parásito es una chinche grande (5 mm), que a pesar de estar clasificada como uno de los parásitos más abundantes en los nidos de cotorra argentina (Briceño-Urzúa et al., 2021) solo fue reportada en dos artículos (Cuadro 3).
Otros parásitos detectados en M. monachus son las garrapatas, en su mayoría nidificantes, principalmente del género Argas spp. Argas monachus solo ha sido reportado en Argentina parasitando específicamente a M. monachus (Mastropaolo et al., 2011; Palomar et al., 2021). Aunque por lo general solo se encuentra en las aves, los humanos pueden ser huéspedes accidentales de este parásito. Las garrapatas son los vectores más importantes en la transmisión de patógenos después de los mosquitos, incluidas las enfermedades zoonóticas y las enfermedades de importancia veterinaria (Ebani y Mancianti, 2021; Palomar et al., 2021).
Al igual que es portadora de una gran variedad de parásitos externos, la cotorra argentina es vector potencial y reservorio de una gran diversidad de parásitos internos. La mayoría de ellos no causan problemas importantes en individuos sanos, pero puede presentarse signos clínicos en animales inmunodeprimidos o susceptibles (Papini et al., 2012). Alrededor de 16 especies de Babesia spp. han sido identificadas en aves (Ebani y Mancianti, 2021). En la presente revisión se observó una baja prevalencia de reportes de Babesia en Myiopsitta mona-chus, siendo mencionada en un solo artículo (i.e., Ruiz-Companioni, 2018). Debido a que existe una morfología similar entre Plasmodium, Haemoproteus y Babesia, es probable que la prevalencia de babesiosis sea mayor de lo informado, debido a errores en el diagnóstico (Samour, 2016).
Se viene demostrando que el número de parásitos y vectores está aumentando en climas cálidos y húmedos en comparación con otros climas (Chapa-Vargas et al., 2020). Esto se debe a que la tasa de reproducción de los dípteros está asociada a una elevada humedad o a la presencia de masas de agua. Varias especies de dípteros actúan comúnmente como vectores de hemoparásitos. Aunque no se encontró significación estadística en el presente estudio, se observa una tendencia positiva a la prevalencia de parásitos conforme se incrementa la temperatura medioambiental.
Se ha reportado que algunas familias y especies de aves, como Psittaciformes y aves marinas, son menos susceptibles a la infección por hemoparásitos, aunque se desconoce las razones (Chapa-Vargas et al., 2020). Esto podría explicar por qué hay una menor incidencia de endoparásitos reportados en la cotorra argentina (27.59%), ya que solo se reportan dos artículos (i.e., Ortiz-Catedral et al. 2019 y Martínez de la Puente et al. 2020).
Existe una gran variedad de especies que forman parte del complejo de la malaria (Plasmodium, Haemoproteus, Leucocytozoon y Fallisia) (Valkiûnas y Iezhova, 2018); sin embargo, se diferencian por el tipo de hospedero que tienen, distribución geográfica, vectores y patogenicidad (Atkinson et al.,2008; Cuevas et al., 2020). Mientras que solo los mosquitos pertenecientes al género Anopheles actúan como vectores en la transmisión de la malaria a los humanos (mamíferos), la malaria aviar es transmitida por dípteros de las familias Culicidae, Simuliidae, Hippoboscidae y Ceratopogonidae (Valkiûnas y Iezhova, 2018; Cuevas et al., 2020), que son capaces de infectar y completar su ciclo en más de 300 especies de aves de 11 órdenes diferentes (Valkiûnas y Iezhova, 2018).
Aproximadamente 130 especies de Haemoproteus se han reportado en 72 familias de aves (Valkiûnas y Iezhova, 2018), infectando a 344 especies de psitácidas con una prevalencia del 30% (Atkinson, 2008a). Plasmodium es un complejo de aproximadamente 40 especies, siete de ellas cosmopolitas; Se ha detectado una gran diversidad de Plasmodium en Passeriformes, Galliformes y Columbiformes (Atkinson, 2008b), sin embargo, no hay reportes en la cotorra argentina.
Leucocytozoon es un género cosmopolita que se encuentra en 113 especies de aves con un patrón de prevalencia en un gradiente desde el sur (región neotropical, 0.1%) hasta el norte (región holártica, 16.2%) (Forrester y Greiner, 2008); sin embargo, solo existe un reporte con baja prevalencia (3.13%) en Myiopsitta monachus en individuos bajo cuidado humano (i.e., Martínez de la Puente et al. 2020). Los efectos a largo plazo de la malaria en las aves hacen que los huéspedes tengan una fase aguda grave cuando se infectan por primera vez, y los animales que sobreviven continúan con una infección crónica, lo que provoca un envejecimiento celular acelerado y la muerte posterior (Asghar et al., 2015).
Debido a sus hábitos gregarios y a la construcción de nidos comunales por Myiopsitta monachus y a la estrecha relación con sus congéneres y con los animales que llegan a ocupar sus nidos (Eberhard, 1998; Viana et al., 2016; Myczko et al., 2017), se facilita la infección con algunos parásitos, entre ellos Cryptosporidium spp. y Giardia spp. (Sandoval-Rodríguez et al., 2021). Estos parásitos se transmiten por vía oro-fecal, infectando a individuos sanos que se encuentran en los nidos (Ludwig y Marques, 2011). Se informa que Falco sparverius utiliza nidos vacíos de cotorra argentina para la incubación, y que a veces comparten estos nidos con polluelos de cotorra argentina, lo que desarrolla un factor de riesgo para la transmisión de diversos agentes infecciosos (Briceño et al., 2019). Hay cerca de 32 especies de Cryptosporidium que son responsables de causar infecciones en aves, mamíferos silvestres y domésticos, reptiles, peces y humanos (Xiao et al., 2002). La transmisión se produce principalmente por vía oro-fecal, pero también por alimentos o agua contaminados. Si bien se han identificado 21 especies de Cryptosporidium, las especies aviares no parecen infectar a los mamíferos (Charlton, 2006). Sin embargo, de las cinco especies identificadas para las aves (C. meleagridis, C. baileyi, C. galli, C. tyzzieri y C. anserinum) (Lindsay y Blagburn, 2008), C. meleagridis puede tener algún riesgo zoonótico (Chappell et al., 2006).
Los protozoarios del género Giardia spp. son patógenos oportunistas que comúnmente afectan a individuos jóvenes, causando problemas gastrointestinales (Acosta et al., 2008). Giardia psittaci y G. ardeae son las especies responsables de causar giardiasis en aves, principalmente en tucanes, Galliformes, Anseriformes y Psittaciformes (Ichikawa et al., 2019). En psitácidas, se ha notificado la presencia de Giardia spp. en Melopsittacus undulatus, Nymphicus hollandicus (Acosta et al., 2008), y en cotorras argentinas introducidas (Sandoval-Rodríguez et al., 2021). Aunque las aves sanas pueden actuar como portadoras asintomáticas, las aves infectadas pueden mostrar signos de diarrea recurrente, pérdida de peso, piel seca, picoteo de plumas, retraso del crecimiento e incluso la muerte (Acosta et al., 2008; Ichikawa et al., 2019). A pesar de que cuentan con una variedad de huéspedes, las infecciones por Giardia son específicas de un solo huésped (Cacciò et al., 2017). G. duodenalis normalmente no infecta a las aves, pero se ha documentado en aves silvestres (Papini et al., 2012; Ichikawa et al., 2019). G. duodenalis infecta a humanos y otros mamíferos (Cacció et al., 2017), por lo tanto, es de gran importancia en la salud pública y veterinaria (Thompson y Monis, 2004).
Los nematodos Ascaris y Heterakis se encuentran entre los parásitos aviares más comunes y cosmopolitas. Las infecciones por Ascaris spp. se presentan, además de aves de producción (Tsegaye-Jnr y Miretie, 2021), con mayor frecuencia en aves de compañía de las especies psitácidas Amazona aestiva, Bolborhynchus lineola, Neopsephotus bourkii, Pionites leucogaster, Pionites melanocephalus, Poicephalus senegalus, Melopsittacus undulatus, Nymphicus hollandicus y Ara macao (López-Garza, 2012; Papini et al., 2012). Los ascáridos en pequeñas cantidades no son de gran importancia; sin embargo, en cargas parasitarias elevadas puede causar debilitamiento y muerte del huésped. Los signos clínicos no aparecen con mucha frecuencia en las aves, por lo que la detección o estudio de estos parásitos se produce con poca frecuencia (Papini et al., 2012).
La introducción de especies invasoras se presenta en todo el mundo y con una tendencia creciente (Chinchio et al., 2020). Se estima que una sola especie exótica puede disminuir la riqueza de especies autóctonas en un 16.6% (Tobin, 2018). Del mismo modo, la introducción de agentes patógenos aumenta el riesgo de infección y transmisión en especies nativas (Lymbery et al., 2014). Si bien, muchos parásitos no logran sobrevivir a nuevas condiciones (Tinsley et al., 2011), su prevalencia puede aumentar y las poblaciones nativas de hospederos disminuyen o se extinguen (Chinchio et al., 2020).
Es fundamental sensibilizar y desarrollar estrategias de control de las especies invasoras, ya que suponen una amenaza para la salud animal y humana, dado que la mayoría de las enfermedades emergentes proceden de animales silvestres. Sin embargo, la falta de información sobre las enfermedades que pueden presentar estas especies es un obstáculo para comprender los riesgos que conllevan (Chinchio et al., 2020). El control de las especies invasoras, una vez establecidas, y la reparación de los daños causados por ellas representa un coste económico a veces considerable, por lo que evitar escapes o liberaciones y regular su comercio sería una de las primeras estrategias para su control y mitigación de daños (Hobson et al., 2017; Tobin, 2018).
CONCLUSIONES
La información recopilada en este trabajo proporciona una base para conocer las especies de endoparásitos y ectoparásitos presentes en la cotorra argentina (Myiopsitta monachus) reportados entre 2000 y 2021 en diversos países.
La cotorra argentina presenta una mayor prevalencia de casos reportados de ectoparásitos (72.41%) que de endoparásitos (27.59%).
Aunque los parásitos específicos de la cotorra argentina no parecen tener un impacto significativo en las especies de aves nativas, la falta de información actualizada y específica sobre los parásitos que podrían afectar a esta especie mantiene la incógnita del potencial riesgo para la salud, incluso de aquellos parásitos de baja patogenicidad, ya que pueden generar impactos nocivos sobre la fauna nativa, aves de producción y la salud humana.
LITERATURA CITADA
1. Acosta I, Soto CJ, Cruz E. 2008. Giardia spp. (Diplomonadidae) en pericos australianos (Melopsittacus undulatus) en Cuba. Rev Salud Anim 30: 63-64. [ Links ]
2. Ancillotto L, Studer V, Howard T, Smith VS, McAlister E, Beccaloni J, Manzia F, et al. 2018. Environmental drivers of parasite load and species richness in introduced parakeets in an urban landscape. Parasitol Res 117: 3591-3599. doi: 10.1007/s00436-018-6058-5. [ Links ]
3. Ángeles-Torres LE, Ducoing-Watty AM, Sila-Castillo RO, Villavicencio-Oropeza A, Maldonado-Reséndiz RI. 2023. Identity and frequency of nontraditional companion animals presented at a university teaching hospital: a retrospective study (2009-2019). Vet Mex OA 10: 1-15. doi: 10.22201/fmvz.24486760e.2023.1083. [ Links ]
4. Appelt CW, Ward LC, Bender C, Fasenella J, Van Vossen BJ, Knight K. 2016. Examining potential relationships between exotic monk parakeets (Myiopsitta monachus) and avian communities in an urban environment. Wilson J Ornithol 128: 556-66. doi: 10.1676/1559-4491-128.3.556. [ Links ]
5. Aramburú RM, Cicchino AC, Corbalán VE. 2000. Ectoparásitos hematófagos en el buche de pichones de Myiopsitta monachus (Boddaert) (Aves: Psittacidae). Neotrópica 46: 74-74. [ Links ]
6. Aramburú RM, Calvo S, Alzugaray ME, Cicchino A. 2003. Ectoparasitic load of monk parakeet (Myiopsitta monachus, Psittacidae) nestlings. Ornitol Neotrop 14: 415-418. [ Links ]
7. Aramburú RM, Campos-Soldini MP. 2008. Presencia de Psitticimex uritui (Hemiptera: Cimicidae) en nidos de caserote Pseudoseisura lophotes (Passeriformes: Furnariidae) en la provincia de Entre Ríos. Rev Soc Entomol Argent 67: 131-133. [ Links ]
8. Asghar M, Hasselquist D, Hansson B, Zehtindjiev P, Westerdahl H, Bensch S. 2015. Hidden cost of infection: chronic malaria accelerates telomere degradation and senescence in wild birds. Science 347: 436-438. doi: 10.1126/science.1261121. [ Links ]
9. Atkinson CT. 2008a. Haemoproteus. En: Atkinson CT, Thomas NJ, Hunter DB (eds). Parasitic diseases of wild birds. Ames, Iowa: John Wiley. p 13-34. [ Links ]
10. Atkinson CT. 2008b. Avian malaria. En: Atkinson CT, Thomas NJ, Hunter DB (eds). Parasitic diseases of wild birds . Ames, Iowa: John Wiley . p 35-53. [ Links ]
11. Atkinson CT, Thomas NJ, Hunter DB. 2008. Parasitic diseases of wild birds . Ames, Iowa: John Wiley . 595 p. [ Links ]
12. Bezerra-Santos MA, Otranto D. 2020. Keds, the enigmatic flies and their role as vectors of pathogens. Acta Trop 209: 105521. doi: 10.1016/j.actatropica.2020.105521. [ Links ]
13. Briceño C, Surot D, González-Acuña D, Martínez FJ, Fredes F. 2017. Parasitic survey on introduced monk parakeets (Myiopsitta monachus) in Santiago, Chile. Braz Vet Parasitol 26: 129-135. doi: 10.1590/S1984-29612017023. [ Links ]
14. Briceño C, Sandoval-Rodríguez A, Yévenes K, Larraechea M, Morgado A, Chappuzeau C, Muñoz V, et al. 2019. Interactions between invasive monk parakeets (Myiopsitta monachus) and other bird species during nesting seasons in Santiago, Chile. Animals 9:923. doi: 10.3390/ani9110923. [ Links ]
15. Briceño-Urzúa C, Yévenes-Coa KA, Larraechea-Bascuñán M, Sandoval-Rodríguez A, Silva de la Fuente MC, Fredes-Martínez FG, Hidalgo-Olate HA, et al. 2021. First record of Ornithonyssus bursa (Berlese, 1888) (Mesostigmata: Macronyssidae) parasitizing invasive monk parakeets in Santiago, Chile. Rev Bras Parasitol Vet 30: e024020. doi: 10.1590/S198429612021023. [ Links ]
16. Cacciò SM, Lalle M, Svärd SG. 2017. Host specificity in the Giardia duodenalis species complex. Infect Genet Evol 66: 335-345. doi: 10.1016/j.meegid.2017.12.001. [ Links ]
17. Cerpa P, Medrano F, Peredo R. 2018. Saltos del desierto al mar: presencia de la pulga Hectopsylla psittaci en la golondrina de mar negra (Oceanodroma markhami) en el norte de Chile. Rev Chil Ornitol 24: 40-42. [ Links ]
18. Chapa-Vargas L, Matta NE, Merino S. 2020. Effects of ecological gradients on tropical avian hemoparasites. En: Santiago-Alarcon D, Marzal A (eds). Avian malaria and related parasites in the tropics: ecology, evolution and systematics. Switzerland: Springer. p 349-377. [ Links ]
19. Chappell CL, Tzipori S, Akiyoshi DE, Okhuysen P, Tanriverdi S, Langer-Curry R, Widmer G. 2006. Cryptosporidium hominis: experimental challenge of healthy adults. Am J Trop Med Hyg 75: 851-857. doi: 10.4269/ajtmh.2006.75.851. [ Links ]
20. Charlton BR. 2006. Avian disease manual. 6a ed. Athens, Georgia: American Association of Avian Pathologists. 235 p. [ Links ]
21. Chinchio E, Crotta M, Romeo C, Drewe JA, Guitian J, Ferrari N. 2020. Invasive alien species and disease risk: an open challenge in public and animal health. PLoS Pathog 16: e1008922. doi: 10.1371/journal.ppat.1008922. [ Links ]
22. Cruz MI, Figueroa CJA, Quintero MMT, Alcalá CY. 2013. Ectoparásitos de aves en explotaciones de traspatio (Gallus gallus domesticus, y Meleagris gallopavo) de una región del sur de México. Rev Ibero-Latinoam Parasitol 72: 185-189. [ Links ]
23. Cuevas E, Daniela Doussang D, Cevidanes A, Quirici V. 2020. Hemosporidios aviares y gradientes latitudinales: oportunidades y desafíos en el Cono Sur de América. Ecosistemas 29: 1974. doi: 10.7818/ECOS.1974. [ Links ]
24. Ebani VV, Mancianti F. 2021. Potential role of avian populations in the epidemiology of Rickettsia spp. and Babesia spp. Vet Sci 8: 334. doi: 10.3390/vetsci8120334. [ Links ]
25. Eberhard JR. 1998. Breeding biology of the monk parakeet. Wilson Bull 110: 463-473. [ Links ]
26. Evangelho-Silva D, Liberato-da Silva G, Moreira-do Nascimento J, Juarez-Ferla N. 2018. Mite fauna associated with bird nests in Southern Brazil. Syst Appl Acarol-UK 23: 426-440. doi: 10.11158/saa.23.3.2. [ Links ]
27. Forrester DJ, Greiner EC. 2008. Leucocytozoonosis. En: Atkinson CT, Thomas NJ, Hunter DB (eds). Parasitic diseases of wild birds . Ames, Iowa: John Wiley . p 54-107. [ Links ]
28. Girisgin AO, Dik B, Girisgin O. 2013. Chewing lice (Phthiraptera) species of wild birds in northwestern Turkey with a new host record. Int J Parasitol Parasites Wildl 2: 217-221. doi: 10.1016/j.ijppaw.2013.07.001. [ Links ]
29. Gómez-Puerta LA, Luján-Vega C. 2018. Contribución al conocimiento de los malófagos (Phthiraptera, Amblycera, Ischnocera) de aves del Perú. Parte 2. Rev Peru Biol 25: 35-42. doi: 10.15381/rpb.v25i1.14346. [ Links ]
30. Hobson EA, Smith-Vidaurre G, Salinas-Melgoza A. 2017. History of nonnative monk parakeets in Mexico. PLoS One 12: e0184771. doi: 10.1371/journal.pone.0184771. [ Links ]
31. Ichikawa RS, Santana BN, Ferrari ED, do Nascimento IG, Nakamura AA, Moraes-Nardi AR, Meireles MV. 2019. Detection and molecular characterization of Giardia spp. in captive Psittaciformes in Brazil. Prev Vet Med 164: 10-12. doi: 10.1016/j.prevetmed.2019.01.006. [ Links ]
32. Lindsay DS, Blagburn BL. 2008. Cryptosporidium. En: Atkinson CT, Thomas NJ, Hunter DB (eds). Parasitic diseases of wild birds . Ames, Iowa: John Wiley . p 195-203. [ Links ]
33. López-Garza H. 2012. Diagnóstico de parásitos gastrointestinales y hemoparásitos en aves psitácidas del Parque Zoológico «Benito Juárez». Tesis de Maestría. Morelia, Michoacán: Universidad Michoacana de San Nicolás de Hidalgo. 54 p. [ Links ]
34. Ludwig R, Marques SMT. 2011. Occurrence of Cryptosporidium spp. oocysts in mammals at a zoo in Southern Brazil. Rev Ibero-Latinoam Parasitol 70: 122-128. [ Links ]
35. Lymbery AJ, Morine M, Kanani HG, Beatty SJ, Morgan DL. 2014. Coinvaders: the effects of alien parasites on native hosts. Int J Parasitol Parasites Wildl 3: 171-177. doi: 10.1016/j.ijppaw.2014.04.002Ch. [ Links ]
36. MacGregor-Fors I, Calderón-Parra R, Meléndez-Herrada A, López-López S, Schondube JE. 2011. Pretty, but dangerous! Records of non-native monk parakeets (Myiopsitta monachus) in Mexico. Rev Mex Biodivers 82: 1053-1056. doi: 10.22201/ib.20078706e.2011.3.721. [ Links ]
37. Martínez-de la Puente J, Díez Fernández A, Montalvo T, Bueno Mari R, Pangrani Q, Soriguer RC, Senar JC, Figuerola J. 2020. Do invasive mosquito and bird species alter avian malaria parasite transmission? Diversity 12: 111. doi: 10.3390/d12030111. [ Links ]
38. Mastropaolo M, Turienzo P, Di Iorio O, Nava S, Venzal JM, Guglielmone A, Mangold AJ. 2011. Distribution and 16S rDNA sequences of Argas monachus (Acari: Argasidae), a soft tick parasite of Myiopsitta monachus (Aves: Psittacidae). Exp Appl Acarol 55: 283-291. doi: 10.1007/s10493-011-9469-x. [ Links ]
39. Mori E, Ancillotto L, Groombridge J, Howard T, Smith VS, Menchetti M. 2015. Macroparasites of introduced parakeets in Italy: a possible role for parasite-mediated competition. Parasitol Res 114: 3277-3281. doi: 10.1007/s00436015-4548-2. [ Links ]
40. Mori E, Pascual-Sala J, Fattorini N, Menchetti M, Montalvo T, Senar JC. 2019. Ectoparasite sharing among native and invasive birds in a Metropolitan area. Parasitol Res 118: 399-409. doi: 10.1007/s00436-018-6174-2. [ Links ]
41. Myczko L, Dylewski L, Sparks TH, Lochyñski M, Tryjanowski P. 2017. Co occurrence of birds and bats in natural nest holes. Ibis 159: 235-237. doi: 10.1111/ibi.12434. [ Links ]
42. Ortiz-Catedral L, Brunton D, Stidworthy MF, Elsheikha HM, Pennycott T, Schulze C, Braun M, et al. 2019. Haemoproteus minutus is highly virulent for Australasian and South American parrots. Parasite Vector 12: 40. doi: 10.1186/s13071-018-3255-0. [ Links ]
43. Palomar AM, Veiga J, Portillo A, Santibáñez S, Václav R, Santibáñez P, Oteo JA, Valera F. 2021. Novel genotypes of nidicolous Argas ticks and their associated microorganisms from Spain. Front Vet Sci 8: 637837. doi: 10.3389/fvets.2021.637837. [ Links ]
44. Papini R, Girivetto M, Marangi M, Mancianti F, Giangaspero A. 2012. Endoparasite infections in pet and zoo birds in Italy. Sci World J 9: 253127. doi: 10.1100/2012/253127. [ Links ]
45. Rodríguez-Maturino JA, Fernández-García JA, Viggers-Carrasco MG, Gómez-Espinoza A, Ríos-Gurrola MG, Arenivas-Villa DE, Guerrero-Guerrero EA. 2018. Distribución de la cotorra argentina (Myiopsitta Monachus) en la ciudad de Durango, México. Acta Zool Mex 34: 1-5. doi: 10.21829/azm.2018.3412151. [ Links ]
46. Ruiz-Companioni I. 2018. Ecología, caracterización de la población y parásitos de la cotorra argentina (Myiopsitta monachus). Una especie exótica invasora en B.C.S. Tesis de Maestría. Baja California Sur, México: CIBNOR. 57 p. [ Links ]
47. Samour J. 2016. Avian medicine. 3a. ed. St. Louis, Missouri: Elsevier Health Sciences. 699 p. [ Links ]
48. Sandoval-Rodríguez A, Marcone D, Alegría-Morán R, Larraechea M, Yévenes K, Fredes F, Briceño C. 2021. Cryptosporidium spp. and Giardia spp. in free-ranging introduced monk parakeets from Santiago, Chile. Animals 11:801. doi: 10.3390/ani11030801. [ Links ]
49. Santillán MÁ, Grande JM, Liébana MS, Martínez P, Diaz LA, Bragagnolo LA, Sarasola JH. 2015. New hosts for the mite Ornithonyssus bursa in Argentina. Med Vet Entomol 29: 439-443. doi: 10.1111/mve.12129. [ Links ]
50. Singh SK, Arya S, Singh SK, Khan V. 2010. Feeding and reproductive behaviour of pigeon slender louse, Columbicola columbae (Phthiraptera, Insecta, Ischnocera). J App Nat Sci 2: 126-133. doi: 10.31018/jans.v2i1.111. [ Links ]
51. Surot-Navarro DA. 2009. Pesquisa de fauna parasitaria de la cotorra argentina (Myiopsitta monachus) en la ciudad de Santiago. Tesis de Médico Veterinario. Santiago de Chile: Univeridad de Chile. 37 p. [ Links ]
52. Sychra O. 2006. Neopsittaconirmus vendulae, a new species of louse (Phthiraptera: Philopteridae) from the Cockatiel Nymphicus hollandicus (Psittaciformes: Cacatuidae). Zootaxa 1270: 57-68. doi: 10.11646/zootaxa.1270.1.5. [ Links ]
53. Thompson RCA, Monis PT. 2004. Variation in Giardia: implications for taxonomy and epidemiology. Adv Parasit 58: 69-137. doi: 10.1016/S0065-308X(04)58002-8. [ Links ]
54. Tinajero R, Rodríguez-Estrella R. 2015. Cotorra argentina (Myiopsitta monachus), especie anidando con éxito en el sur de la Península de Baja California. Acta Zool Mex 31: 190-197. doi: 10.21829/azm.2015.312540. [ Links ]
55. Tinsley RC, York JE, Everard ALE, Scott LC, Chapple SJ, Tynsley MC. 2011. Environmental constraints influencing survival of an African parasite in a north temperate habitat: effects of temperature on egg development. Parasitology 138:1029-1038. doi: 10.1017/S0031182011000461. [ Links ]
56. Tobin PC. 2018. Managing invasive species. F1000Research 7: 1686. doi: 10.12688/f1000research.15414.1. [ Links ]
57. Tsegaye-Jnr AA, Miretie AA. 2021. Chicken ascariasis and heterakiasis: prevalence and associated risk factors, in Gondar City, Northwest Ethiopia. Vet Med-Res Rep 12: 217-223. doi: 10.2147/VMRR.S323284. [ Links ]
58. Valkiûnas G, Iezhova TA. 2018. Keys to the avian malaria parasites. Malaria J 17: 212. doi: 10.1186/s12936-018-2359-5. [ Links ]
59. Viana IR, Strubbe D, Zocche JJ. 2016. Monk parakeet invasion success: a role for nest thermoregulation and bactericidal potential of plant nest material? Biol Invasions 18: 1305-1315. doi: 10.1007/s10530-016-1068-7. [ Links ]
60. Walker MD, Rotherham ID. 2010. The common swift louse fly, Crataerina pallida: an ideal species for studying host-parasite interactions. J Insect Sci 10:193. doi: 10.1673/031.010.19301. [ Links ]
61. Wolpert-de Gois LF, Costa-Carvalho L, Dourado-Fontenele R, Maia-Silva CL, Mousinho-Freire S, de Melo-Evangelista LS. 2022. Ocorrência de piolhos Neopsittaconirmus spp. (Phthiraptera: Ischnocera: Philopteridae) em calopsita (Nymphicus hollandicus) no nordeste brasileiro. Medicina Veterinária (UFRPE) 16: 81-87. doi: 10.26605/medvet-v16n2-4995. [ Links ]
62. Xiao L, Sulaiman IM, Ryan UM, Zhou L, Atwill ER, Tischler ML, Zhang X, et al. 2002. Host adaptation and host parasite co-evolution in Cryptosporidium: implications for taxonomy and public health. Int J Parasitol 32: 1773-1785. doi: 10.1016/S0020-7519(02)00197-2. [ Links ]
Recibido: 02 de Agosto de 2024; Aprobado: 06 de Marzo de 2025
* Autor de correspondencia: Luis M García-Feria; luis.garcia@inecol.mx

Decano: Dr. Fernando Carcelén Cáceres
Vicedecano Académico y de pregrado: Dr. Alexei Vicent Santiani Acosta
Vicedecano de Investigación y Posgrado: Dr. Raúl Héctor Rosadio Alcántara
Copyright ©2025 Todos los Derechos Reservados
Desarrollado por Unidad de Estadística e Informática de la Facultad de Medicina Veterinaria de la UNMSM
