
Laboratorio de Investigación y Educación Biosocial Tonalli Ltda., Temuco, Chile.
Laboratorio de Investigación y Educación Biosocial Tonalli Ltda., Temuco, Chile.
Mares Limpios SpA., Puerto Montt, Chile.
Aton investigación aplicada, San José, Costa Rica.
Laboratorio de Investigación y Educación Biosocial Tonalli Ltda., Temuco, Chile.
Aton investigación aplicada, San José, Costa Rica.
In vitro models for the development of sustainable aquaculture. The application of the cell line model
ABSTRACT
In vitro models are widely used in various disciplines, allowing more tests to be performed in less time. Within biotechnology, cell models play a prominent role. This article reviews the utility and versatility of cell lines in the context of aquaculture, focusing on their applications in nutrition, health and environmental assessment. It shows how the use of cell lines can provide enlightening results, reducing both the time and costs of testing, and increasing the diversity of experiments that can be performed. In the aquaculture industry, there is a constant challenge to improve diets using additives and to understand the mechanisms of action of each compound. These processes are not commonly observed in vitro, much less in cell models. Although the development of aquaculture cell lines applied to the analysis of feed supplements or feed treatments is still incipient, in recent years this model has been introduced for the screening of molecules, pharmacological studies and description of some mechanisms of action, offering preliminary results for the development of diets or longer in vivo studies. However, a major challenge remains to achieve its use as a preliminary tool for generating sustainable aquaculture practices. Cell lines represent a multifaceted tool in aquaculture, providing information on the effects of new molecules incorporated into the production industry.
Keywords: aquaculture; cell lines; costs; in vitro; nutrition
Líneas Celulares
Los cultivos celulares son fundamentales para la investigación productiva en peces y vertebrados en general. Su aplicación en la exploración de aditivos, su interacción con órganos y la aparición de efectos secundarios proporciona un suministro ilimitado en el diagnóstico de alteraciones producidas por estos (Blagodatski y Katanaev, 2011; Wuest et al., 2012). Aunque su implementación en la acuicultura es relativamente reciente, en mamíferos la trasferencia de información desde el nivel celular a modelos complejos es una práctica común (Krampe y Al-Rubeai, 2010). Por consiguiente, comprender los efectos a nivel celular del compuesto en modelos de peces representa una oportunidad para mejorar la comprensión de su fisiología y evitar toxicidad asociada con la exposición crónica (Rolland et al., 2005; Saito et al., 2008).
Ante esta perspectiva, surgen interrogantes como ¿por qué utilizar una línea celular? o ¿es posible utilizar una misma línea celular para diferentes organismos? Muchas proteínas, enzimas y receptores se expresan de manera constitutiva; es decir, en distintos tipos celulares. Por ejemplo, los receptores de crecimiento (IGF), las caspasas o las señales de apoptosis, sin duda están presente en todos los tipos celulares, así como la enzima óxido nítrico sintetasa (eNOS), generadora de óxido nítrico, que se expresa y funciona desde las neuronas al endotelio (Flores et al., 2003). Por lo tanto, para investigar un efecto de base, como la capacidad de una molécula para prevenir la apoptosis inducida por estrés oxidativo, se puede emplear cualquier línea celular y extrapolar el efecto de la molécula a otros organismos.
Asimismo, se ha demostrado que en la búsqueda de compuestos activos en la industria farmacéutica se utiliza una línea celular de hámster (HEK-293) (Ormeño et al., 2013). A partir de las respuestas en esta línea, se procede a investigar en otras líneas más relacionadas con el órgano diana, luego con el organismo completo, para finalizar en las pruebas clínicas. Incluso si no se dispone de acceso a una línea celular específica, se puede usar este modelo para expresar receptores de otras células y estudiar sus efectos. Por ejemplo, el uso de HEK-293 para estudiar el efecto del etanol en los receptores de neuronas espinales de ratón, con el objetivo de evaluar los efectos anestésicos clínicos en humanos (Yevenes et al., 2003).
Entonces, ¿cuándo se requiere especificidad celular? Se necesita cuando se busca analizar una función en particular. En el ejemplo del óxido nítrico (NO), una enzima que se expresa constitutivamente y cuya maquinaria puede encontrarse en cada célula de vertebrados. Al enfrentar una molécula que aumente la producción de NO se pueden determinar por muchos tipos de modelos celulares cuál de ellos produce más NO. Sin embargo, si el interés radica en describir el efecto de la molécula en la función vascular, como modular el ATP a través de receptores específicos para inducir la producción de NO, es necesario emplear una línea de endotelio, independientemente de la especie, ya que esto ayudar a comprender el mecanismo específico (Parodi et al., 2002). Otro ejemplo es la acumulación de glicógeno intracelular, un fenómeno característico de los hepatocitos y que puede modelarse en células, pero de manera muy específica (Olivares-Ferretti et al., 2024). Sin embargo, si se desea estudiar el efecto del NO en la función neuronal, el modelo de endotelio mencionado anteriormente podría indicar un aumento en el NO en otras líneas celulares, pero no proporcionaría información de su efecto. En este caso, sería necesario utilizar un modelo más específico (Parodi et al., 2015) para estudiar mecanismos más complejos.
Esta perspectiva lleva a proponer la utilidad y versatilidad de las líneas celulares en el estudio de las respuestas a nuevos aditivos incorporados en la industria y a la toxicidad de contaminantes acuáticos. Además, se debe destacar las ventajas en términos de costo y tiempo que presentan, así como su potencial aplicación en la mejora de prácticas acuícolas sostenibles. Esto ofrece una alternativa valiosa a los estudios in vivo proporcionando una comprensión más completa de los procesos fisiológicos y patológicos en las especies acuícolas.
Líneas Celulares en Acuicultura
El establecimiento y caracterización de líneas celulares de diversas especies acuícolas, como peces, mariscos y algas, además de diferentes tipos de tejido, ha demostrado ser de gran utilidad en diversas áreas. Estas líneas celulares son modelos in vitro mantenidos en condiciones de laboratorio, que presentan ventajas notables en términos de adaptación a entornos controlados, resistencia a condiciones desafiantes como la hipoxia y una mayor vida útil (Lakra et al., 2011).Además, su breve impacto versus otros modelos como sería in vivo contribuye a la preservación de ambientes acuáticos, respaldando la sostenibilidad de sistemas acuícolas y minimizando los impactos negativos (Subbiahanadar Chelladurai et al., 2021).
Estas líneas celulares se obtienen a partir de diversos tejidos de peces y otras especies marinas, incluyendo branquias (Wolf et al., 1966), ojos (Parameswaran et al., 2006), hígado (Ou-yang et al., 2010), riñón (Dannevig et al., 1997), intestino (Kawano et al., 2011), cerebro (Balmer et al., 2018), vértebras (Segner et al., 1994) y morro (Scott et al., 2021), entre otros. Su utilidad, entre otras áreas, se extiende al tamizaje de moléculas y evaluación de funciones celulares, lo que facilita la identificación y desarrollo de nuevos aditivos, dietas y compuestos destinados a mejorar la producción y calidad de las especies cultivadas.
Se tienen registradas 908 líneas celulares de peces y 5 de moluscos, de un total de 144 568 enlistadas en la base de datos de conocimiento sobre líneas celulares Cellulosaurus (Bairoch, 2018). Dentro de la acuicultura, diversas líneas celulares se utilizan para una variedad de aplicaciones específicas. Entre las más destacadas se encuentran la línea celular RTG-2 de Oncorhynchus mykiss (Wolf y Quimby, 1962), CCB de Cyprinus carpio carpio (Neukirch et al., 1999), THK de Oreochromis niloticus (Yadav et al., 2021) y de camarón como Penaeus vannamei (Jayesh et al., 2012). Estas líneas celulares se emplean no solo en la investigación de virus y enfermedades, sino también en la producción de proteínas recombinantes entre otros propósitos.
La investigación biotecnológica ha permitido explorar nuevas aplicaciones de las líneas celulares en acuicultura. Su potencial se ha ampliado para incluir el análisis de aditivos y suplementos en la dieta de las especies (Olivares-Ferreti et al., 2024). Además de su función convencional en el estudio de patógenos, las líneas celulares han demostrado su valía en la formulación de alimentos para peces, analizando la proliferación celular, la protección contra la oxidación, el sinergismo y otros aspectos (Olivares-Ferreti et al., 2020).
Recientes avances han impulsado la creación de diversidad de modelos para la investigación, como las líneas celulares RTpi-MI y derivadas de O. mykiss (Pasquariello et al., 2021), así como la línea Bge de caracol Biomphalaria glabrata (Laursen y Yoshino, 1999). Además, se han aplicado técnicas de ingeniería genética, como CRISPRCas9 en la línea celular CHSE-214 para mejorar su capacidad de producción y resistencia a enfermedades (Dehler et al., 2016).
Las líneas celulares también se han convertido en modelos útiles para abordar consultas nutricionales basadas en vías fundamentales, particularmente en la regulación de la homeostasis celular a través de aminoácidos permitiendo investigar la señalización de detección de nutrientes (Brasse-Lagnel et al., 2010). Estudios han demostrado que las líneas celulares de O. mykiss pueden servir como alternativas in vitro para analizar cuestiones nutricionales en esta especie y otros peces carnívoros, especialmente al considerar proteínas dietéticas que son responsables de la mayor parte del metabolismo energético (Morin et al., 2020). Asimismo, se han utilizado varias líneas celulares de peces para estudiar el alargamiento y desaturación de ácidos grasos poliinsaturados, desvelando los mecanismos proinflamatorios relacionados con la dieta de ácidos grasos, como es el caso de la línea celular CHH-1 derivada del corazón de Oncorhynchus keta (Gordon Bell y Sargent, 1992). Esto destaca la versatilidad en la utilización de estas líneas celulares en análisis nutricionales de dietas en especies productivas.
Un aspecto particularmente interesante en la industria salmonicultura es la acuacultura celular, que busca generar productos cárnicos de origen acuático a partir de cultivos celulares de tejido muscular de pez (Goswami et al., 2022a). Esta innovación enfrenta los desafíos actuales y promete ser una alternativa sustentable para producir pescado de alta calidad.
Aplicaciones de Líneas Celulares en Nutrición y Salud
En el contexto de la acuicultura, las líneas celulares representan una herramienta multifacética con una amplia variedad de aplicaciones. Estas líneas celulares además de ser catalogadas según sus características, también puede considerar su versatilidad que les permite contribuir significativamente a una serie de disciplinas de investigación, en especial en los campos de la nutrición, la genética, la toxicología, la patología y la inmunología (Goswami et al., 2022b).
Los estudios in vitro basados en líneas celulares han revelado profundos conocimientos científicos que pueden ser traducidos en aplicaciones prácticas dentro de la industria acuícola (Bols 1991). Estos estudios permiten una manipulación precisa de los procesos biológicos y de manejo productivo, lo que conduce a mejoras en la salud y el rendimiento de las especies cultivadas. En particular, las líneas celulares se han convertido en una herramienta invaluable para comprender los mecanismos de acción de diversos compuestos, incluyendo fármacos y productos químicos, en el organismo de los peces (Hernández-Moreno et al., 2022). La presente revisión proporciona información crucial sobre los efectos biológicos y toxicológicos de estos compuestos a nivel celular, lo que, a su vez, contribuye a una comprensión más profunda de su impacto en la salud y el bienestar de las especies acuícolas.
La aplicación más destacada de las líneas celulares de peces se encuentra en el diagnóstico de enfermedades y los estudios inmunológicos. Numerosas revisiones han recopilado la utilidad de los cultivos celulares en diversas áreas, como estudios patológicos, inmunológicos (Lulijwa et al., 2019), ingeniería genética (Lim y Gong, 2013), estudios transgénicos y biotecnología reproductiva (Lee et al., 2015), vacunas (Mondal y Thomas, 2022) y estudios de vigilancia toxicológica y ambiental (Lee et al., 2015).
En este contexto, esta revisión se centra en su aplicación en la nutrición y el metabolismo de las especies acuícolas, con un enfoque particular en la evaluación de nuevos aditivos en la alimentación. La formulación de alimentos para peces se enfrenta constantemente a desafíos, ya que busca mejorar la conversión alimenticia, incorporar vitaminas y minerales, y abordar factores ambientales, toxicológicos y patológicos (Shearer, 2002). Las líneas celulares de peces ofrecen un modelo in vitro excepcional para el estudio de la absorción y asimilación de nutrientes y aditivos (Lakra et al., 2011).
Durante la última década, el equipo de investigación ha demostrado de manera concluyente la aplicabilidad de estas líneas celulares, centrándose en Salmo salar (SHK-1) y Oncorhynchus tshawytscha (CHSE-214). El equipo ha innovado en la utilidad primaria de estas líneas, empleadas para investigar el virus de la anemia infecciosa del salmón (ISA) en el caso de SHK-1 (Dannevig et al., 1995), mientras que CHSE-214 se ha utilizado para estudiar una amplia gama de virus comunes debido a su especial susceptibilidad (Lorenzen et al., 1999). En general, los resultados obtenidos de enfrentar las células a diferentes aditivos han proporcionado respuestas adecuadas en términos de la proliferación celular (Sanchez et al., 2016), la capacidad de suprimir el ayuno (Olivares et al., 2016), el estrés oxidativo (Sanchez et al., 2016), los efectos sinérgicos entre aditivos (Olivares-Ferretti et al.,2020) y la ecotoxicidad (Olivares-Ferretti et al., 2019).
Las moléculas funcionales de los alimentos ejercen su acción tanto a nivel del organismo en su totalidad como localmente en el intestino, lo que puede tener un efecto directo en la microbiota intestinal (Ringø et al., 2016) y en las funciones metabólicas (Torrecillas et al., 2014). Un ejemplo destacado son los nucleótidos, que desempeñan un papel crucial en una variedad de funciones intestinales normales, incluyendo el crecimiento, el metabolismo de los nutrientes, el sistema inmunológico y la reparación de tejidos (Gil, 2002). Los estudios del equipo de investigación han identificado el potencial de los nucleótidos para reducir los efectos tóxicos inducidos por el ayuno y ejercer efectos citoprotectores (Olivares et al., 2016). De manera similar, la silimarina, conocida por sus efectos hepatoprotectores, ha demostrado ser un potente agente en los modelos celulares (Abenavoli et al., 2010). Bajo su efecto se observa una proliferación celular, así como una reducción de la toxicidad oxidativa (Sanchez et al., 2016). La combinación de silimarina y taurina también reveló un efecto sinérgico en estos mismos parámetros (Espe y Holen, 2013; López et al., 2015). Si bien estos resultados a nivel celular pueden parecer sencillos, su aplicabilidad en la formulación de piensos en la acuicultura simplifica y reduce los costos de evaluación, al tiempo que ofrece un potencial real para mejorar la conversión alimenticia y el crecimiento de las especies productivas.
No obstante, la principal limitación en este campo radica en la falta de líneas celulares de origen gastroentérico, particularmente intestinal (Morin et al., 2020). Esta carencia se traduce en una limitación de proteínas y enzimas específicas para la investigación, lo que, a su vez, obstaculiza la comprensión de los efectos subyacentes de los ingredientes de las formulaciones alimenticias de los peces. A pesar de la aplicabilidad de las líneas celulares existentes, la disponibilidad de líneas celulares específicas del intestino (Pasquariello et al., 2021) facilitaría estudios futuros sobre los efectos de los ingredientes y aditivos en diversos aspectos de la fisiología de los peces, incluyendo aspectos patológicos previamente mencionados.
Los cultivos celulares desarrollados a partir de peces ofrecen una plataforma de estudio eficaz para investigar la asimilación y el metabolismo de nutrientes en los peces. Sin embargo, rara vez se han empleado para estudiar este aspecto crucial de su nutrición. La proyección más significativa con el uso de líneas celulares de peces es su capacidad para abordar consultas nutricionales basadas en las condiciones celulares, incluyendo mecanismos moleculares relacionados con la nutrición de peces, particularmente en el contexto de la miogénesis (Cleveland, 2014) y de la conversión alimenticia (Morin et al., 2020).
Una aplicación poco explorada es su uso como indicadores de efectos ecotóxicos (Segner 1998; Fent, 2001), particularmente con relación a especies presentes en el entorno que puedan afectar adversamente a sistemas y procesos relacionados con la acuicultura, como los sistemas de recirculación acuícola y las etapas biológicas reproductivas de los salmones. Un ejemplo destacado es Didymosphenia geminata, considerada una especie invasora en el hemisferio sur (Montecino et al., 2016), lo que la convierte en una preocupación relevante en las corrientes naturales de agua. Los estudios efectuados han revelado efectos perjudiciales en la proliferación celular a partir del enfrentamiento de un extracto de polifenoles de esta diatomea, lo que sugiere efectos crónicos en las especies acuáticas expuestas (Olivares-Ferretti et al., 2019). Sería conveniente considerar la utilización de modelos celulares de otros tejidos, como branquias y musculatura, para determinar efectos en el crecimiento del individuo, así como evaluar el empleo de recursos contaminados con D. geminata. El uso de líneas celulares en esta área de evaluación podría convertirse en una herramienta fundamental para desarrollar nuevas estrategias de producción y gestionar las especies cultivadas de manera más eficiente.
Costos y Tiempo, Estudios in vivo y en Líneas Celulares
Los estudios in vivo, es decir, realizados en modelos animales o humanos, tienden a ser más costosos que los estudios en líneas celulares. Principalmente, debido a la necesidad de mantención, como sería disponer de alojamiento, alimentación y cuidado de los animales, así como el reclutamiento y seguimiento de los participantes en el caso de los estudios clínicos en humanos (Akhtar, 2012; Cathers et al., 2022). En acuicultura, en las pruebas de nuevas formulaciones de pienso, además de las consideraciones principales, también se puede incluir evaluaciones adicionales para medir los resultados de las intervenciones dietéticas, como serían: los análisis de sangre, evaluación de la función hepática, mediciones antropométricas, y cuestionarios de dieta, entre otros. Estos análisis aumentarían el costo total del estudio (Cuanalo-Contreras y Benkmann, 2022). En esta línea, podemos indicar que el costo de las pruebas de dietas en centros experimentales puede ser alto, debido a la naturaleza de los estudios in vivo y la cantidad de recursos necesarios para llevar a cabo las evaluaciones necesarias.
La planificación y la elaboración de un presupuesto cuidadoso antes de iniciar cualquier estudio es importante para asegurar que los recursos estén disponibles y se utilicen de manera efectiva (Badiola et al., 2012). El tiempo necesario para realizar pruebas de dietas en centros de estudios puede variar dependiendo de factores, como el diseño del estudio, el número de sujetos involucrados y la duración de la intervención dietética (Lorian, 1988). En general, los estudios in vivo pueden requerir un periodo de tiempo más largo debido a la necesidad de las actividades protocolares, así como a la recolección y análisis de datos (Cuanalo-Contreras y Benkmann, 2022). Además, la disponibilidad de recursos y financiamiento también puede limitar la capacidad de los centros de estudios para llevar a cabo pruebas de dietas in vivo (Akhtar, 2012).
En cuanto a los niveles de incertidumbre, es importante tener en cuenta que los estudios in vivo son inherentemente más complejos y pueden estar sujetos a más fuentes de inferencia que los estudios en líneas celulares. Además, los factores como la escasez individual y las diferencias en la composición de la dieta y el estilo de vida de los sujetos pueden influir en los resultados del estudio (Lorian, 1988; Akhtar, 2012). El acceso a los sujetos para pruebas in vivo puede ser un desafío, ya que la selección de los participantes adecuados y la obtención de su consentimiento son importantes consideraciones éticas.
Al avanzar hacia estudios en modelos in vivo, es importante considerar la calidad y la precisión de estos a través del uso de técnicas avanzadas en el análisis de datos y la estandarización de los protocolos de intervención. Por lo que, también es importante considerar modelos que pueden proporcionar información valiosa y complementaria sobre los efectos de la dieta en la biología celular y molecular, como son los estudios preliminares en líneas celulares (Cano et al., 2019). En general, la combinación de estudios in vivo y en líneas celulares puede proporcionar una comprensión más completa de los efectos de la dieta en la salud y la enfermedad, lo que puede tener importantes implicaciones para la prevención y el tratamiento de enfermedades crónicas.
Conclusiones Generales
Los modelos celulares permiten obtener resultados interesantes sobre el efecto de nuevas moléculas en dietas y tratamientos en la industria acuícola a nivel inicial, además de servir de apoyo como bioindicadores ambientales frente a patógenos o toxinas. Se le considera un modelo menos costoso debido a que se pueden realizar en condiciones de laboratorio con menos necesidades de infraestructura y equipo especializado, y la posibilidad de realizar múltiples experimentos en paralelo (Cano et al., 2019). Sin embargo, se debe considerar que los estudios celulares no pueden replicar completamente la complejidad de los sistemas biológicos in vivo y pueden ser menos relevantes para la comprensión de la fisiología y el comportamiento del organismo completo (Kántás et al., 2021). Además, los estudios celulares pueden estar sujetos a otras limitaciones, como la dificultad de mantener las células vivas y saludables durante periodos prolongados, y la falta de respuesta de las células a ciertos estímulos en comparación con un organismo completo (Isoherranen y Foti, 2020).
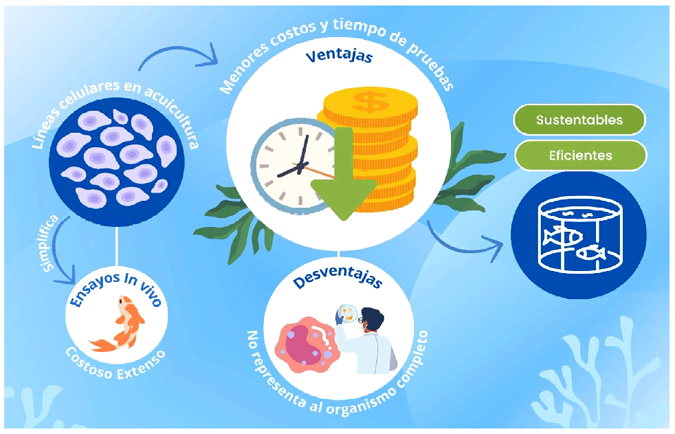
La Figura 1 representa un modelo resumen de la revisión, donde la idea de usar líneas celulares permite facilitar los estudios in vivo al reducir tiempo y costo de pruebas de nuevos aditivos, ya que a pesar de algunas desventajas es un modelo de uso para el desarrollo de dietas en animal de producción.
LITERATURA CITADA
1. Abenavoli L, Capasso R, Milic N, Capasso F. 2010. Milk thistle in liver diseases: past, present, future. Phytother Res 24: 1423-1432. doi: 10.1002/ptr.3207. [ Links ]
2. Akhtar A. 2012. The costs of animal experiments. In: Animals and public Health. London, UK: Macmillan. p 132-167. doi: 10.1057/9780230358522_6. [ Links ]
3. Badiola M, Mendiola D, Bostock J. 2012. Recirculating aquaculture systems (RAS) analysis: main issues on management and future challenges. Aquacult Eng 51: 26-35. doi: 10.1016/j.aquaeng.2012.07.004. [ Links ]
4. Bairoch A. 2018. The cellosaurus, a cellline knowledge resource. J Biomol Tech 29: 25-38. doi: 10.7171/jbt.18-2902-002. [ Links ]
5. Balmer BF, Getchell RG, Powers RL, Lee J, Zhang T, Jung ME, Purcell MK, et al. 2018. Broad-spectrum antiviral JL122 blocks infection and inhibits transmission of aquatic rhabdoviruses. Virology 525: 143-149. doi: 10.1016/j.virol.2018.09.009. [ Links ]
6. Blagodatski A, Katanaev VL. 2011. Technologies of directed protein evolution in vivo. Cell Mol Life Sci 68: 1207-1214. doi: 10.1007/s00018-0100610-5. [ Links ]
7. Bols NC. 1991. Biotechnology and aquaculture: The role of cell cultures. Biotechnol Adv 9: 31-49. doi: 10.1016/0734-9750(91)90403-I. [ Links ]
8. Brasse-Lagnel CG, Lavoinne AM, Husson AS. 2010. Amino acid regulation of mammalian gene expression in the intestine. Biochimie 92: 729-735. doi: 10.1016/j.biochi.2010.02.021. [ Links ]
9. Cano I, Taylor NG, Bayley A, Gunning S, McCullough R, Bateman K, Nowak BF, Paley RK. 2019. In vitro gill cell monolayer successfully reproduces in vivo Atlantic salmon host responses to Neoparamoeba perurans infection. Fish Shellfish Immun 86: 287-300. doi: 10.1016/j.fsi.2018.11.029. [ Links ]
10. Cathers HS, Mane SP, Tawari NR, Balakuntla J, Plata G, Krishnamurthy M, MacDonald A, et al. 2022. In silico, in vitro and in vivo characterization of host-associated Latilactobacillus curvatus strains for potential probiotic applications in farmed Atlantic salmon (Salmo salar). Sci Rep 12: 18417. doi: 10.1038/s41598-022-23009-y. [ Links ]
11. Cleveland BM. 2014. In vitro and in vivo effects of phytoestrogens on protein turnover in rainbow trout (Oncorhynchus mykiss) white muscle. Comp Biochem Phys C 165: 9-16. doi: 10.1016/j.cbpc.2014.05.003. [ Links ]
12. Cuanalo-Contreras K, Benkmann D. 2022. Towards more human and humane testing: the role of the device supplier industry. Altern Lab Anim 50: 62-70. doi: 10.1177/02611929211073132. [ Links ]
13. Dannevig BH, Brudeseth BE, Gjøen T, Rode M, Wergeland HI, Ovensen Ø, Press CM. 1997. Characterisation of a long-term cell line (SHK-1) developed from the head kidney of Atlantic salmon (Salmo salar L.). Fish Shellfish Immun 7: 213-226. doi: 10.1006/fsim.1996.0076. [ Links ]
14. Dannevig BH, Falk K, Namork E. 1995. Isolation of the causal virus of infectious salmon anaemia (ISA) in a long-termcell line from Atlantic salmon head kidney. J Gen Virol 76: 1353-1359. doi: 10.1099/0022-1317-76-6-1353. [ Links ]
15. Dehler CE, Boudinot P, Martin SAM, Collet B. 2016. Development of an efficient genome editing method by CRISPR/Cas9 in a fish cell line. Mar Biotechnol 18: 449-452. doi: 10.1007/s10126-016-9708-6. [ Links ]
16. Espe M, Holen E. 2013. Taurine attenuates apoptosis in primary liver cells isolated from Atlantic salmon (Salmo salar). Brit J Nutr 110: 20-28. doi: 10.1017/S0007114512004679. [ Links ]
17. Fent K. 2001. Fish cell lines as versatile tools in ecotoxicology: assessment of cytotoxicity, cytochrome P4501Ainduction potential and estrogenic activity of chemicals and environmental samples. Toxicol inVitro 15:477-488. doi: 10.1016/S0887-2333(01)00053-4. [ Links ]
18. Flores C, Rojas S, Aguayo C, Parodi J, Mann G, Pearson JD, Casanello P, Sobrevia L. 2003. Rapid stimulation of L-arginine transport by D-glucose involves p42/44(mapk) and nitric oxide in human umbilical vein endothelium. Circ Res 92: 64-72. doi: 10.1161/01.res.0000048197.78764.d6. [ Links ]
19. Gil A. 2002. Modulation of the immune response mediated by dietary nucleotides. Eur J Clin Nutr 56: S1-S4. doi: 10.1038/sj.ejcn.1601475. [ Links ]
20. Gordon Bell J, Sargent JR. 1992. The incorporation and metabolism of polyunsaturated fatty acids in phospholipids of cultured cells from chum salmon (Oncorhynchus keta). Fish Physiol and Biochem 10: 99-109. doi: 10.1007/BF00004521. [ Links ]
21. Goswami M, Belathur Shambhugowda Y, Sathiyanarayanan A, Pinto N, Duscher A, Ovissipour R, Lakra WS, et al. 2022. Cellular aquaculture: prospects and challenges. Micromachines 13: 828. doi: 10.3390/mi13060828. [ Links ]
22. Goswami M, Yashwanth BS, Trudeau V, Lakra WS. 2022. Role and relevance of fish cell lines in advanced in vitro research. Mol Biol Rep 49: 2393-2411. doi: 10.1007/s11033-021-06997-4. [ Links ]
23. Hernández-Moreno D, Blázquez M, Navas J, Fernández-Cruz M. 2022. Fish cell lines as screening tools to predict acute toxicity to fish of biocidal active substances and their relevant environmental metabolites. Aquat Toxicol 242: 106020. doi: 10.1016/j.aquatox.2021.106020. [ Links ]
24. Isoherranen N, Foti RS. 2020. In vitro characterization and in vitro to in vivo predictions of drug-drug interactions. In: Identification and quantification of drugs, metabolites, drug metabolizing enzymes, and transporters. Elsevier. p 273-309. doi: 10.1016/B978-0-12-820018-6.00009-0. [ Links ]
25. Jayesh P, Seena J, Singh IS. 2012. Establishment of shrimp cell lines: perception and orientation. Indian J Virol 23: 244-251. doi: 10.1007/s13337-012-0089-9. [ Links ]
26. Kántás B, Szõke É, Börzsei R, Bánhegyi P, Asghar J, Hudhud L, Steib A, et al. 2021. In silico, in vitro and in vivo pharmacodynamic characterization of novel analgesic drug candidate somatostatin SST4 receptor agonists. Front Pharmacol 11:601887. doi: 10.3389/fphar.2020.601887. [ Links ]
27. Kawano A, Haiduk C, Schirmer K, Hanner R, Lee LEJ, Dixon B, Bols NC. 2011. Development of a rainbow trout intestinal epithelial cell line and its response to lipopolysaccharide. Aquacult Nutr 17: e241-e252. doi: 10.1111/j.13652095.2010.00757.x. [ Links ]
28. Krampe B, Al-Rubeai M. 2010. Cell death in mammalian cell culture: molecular mechanisms and cell line engineering strategies. Cytotechnology 62: 175-188. doi: 10.1007/s10616-0109274-0. [ Links ]
29. Lakra WS, Swaminathan TR, Joy KP. 2011. Development, characterization, conservation and storage of fish cell lines: a review. Fish Physiol Biochem 37: 1-20. doi: 10.1007/s10695-010-9411-x. [ Links ]
30. Laursen JR, Yoshino TP. 1999. Biomphalaria glabrata embryonic (Bge) cell line supports in vitro miracidial transformation and early larval development of the deer liver fluke, Fascioloides magna. Parasitology 118: 187-194. doi: 10.1017/S0031182098003710. [ Links ]
31. Lee O, Green JM, Tyler CR. 2015. Transgenic fish systems and their application in ecotoxicology. Crit Rev Toxicol 45: 124-141. doi: 10.3109/10408444.2014.965805. [ Links ]
32. Lim JM, Gong SP. 2013. Somatic cell transformation into stem cell-like cells induced by different microenvironments. Organogenesis 9: 245-248. doi: 10.4161/org.26202. [ Links ]
33. López LM, Flores-Ibarra M, Bañuelos-Vargas I, Galaviz MA, True CD. 2015. Effect of fishmeal replacement by soy protein concentrate with taurine supplementation on growth performance, hematological and biochemical status, and liver histology of totoaba juveniles (Totoaba macdonaldi). Fish Physiol Biochem 41: 921-936. doi: 10.1007/s10695-015-0058-5. [ Links ]
34. Lorenzen E, Carstensen B, Olesen N. 1999. Inter-laboratory comparison of cell lines for susceptibility to three viruses: VHSV, IHNV and IPNV. Dis Aquat Organ 37: 81-88. doi: 10.3354/dao037081. [ Links ]
35. Lorian V. 1988. Differences between in vitro and in vivo studies. Antimicrob Agents Ch 32: 1600-1601. doi: 10.1128/AAC.32.10.1600. [ Links ]
36. Lulijwa R, Alfaro AC, Merien F, Meyer J, Young T. 2019. Advances in salmonid fish immunology: a review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immun 95: 44-80. doi: 10.1016/j.fsi.2019.10.006. [ Links ]
37. Mondal H, Thomas J. 2022. A review on the recent advances and application of vaccines against fish pathogens in aquaculture. Aquacult Int 30: 1971-2000. doi: 10.1007/s10499-022-00884-w. [ Links ]
38. Montecino V, Molina X, Bothwell M, Muñoz P, Carrevedo ML, Salinas F, Kumar S, et al. 2016. Spatio temporal population dynamics of the invasive diatom Didymosphenia geminata in central-southern Chilean rivers. Sci Total Environ 568: 1135-1145. doi: 10.1016/j.scitotenv.2016.03.080. [ Links ]
39. Morin G, Pinel K, Dias K, Seiliez I, Beaumatin F. 2020. RTH-149 cell line, a useful tool to decipher molecular mechanisms related to fish nutrition. Cells 9: 1754. doi: 10.3390/cells9081754. [ Links ]
40. Neukirch M, Bottcher K, Bunnarjirakul S. 1999. Isolation of a virus from koi with altered gills. Bull Eur Assn Fish P 19: 221-224. [ Links ]
41. Olivares-Ferretti P, Chavez V, Maguregui E, Jiménez S, Colom O, Parodi J. 2024. Exploring the metabolic andantioxidant potential of solergy: implications for enhanced animal production. Biotechnol Rep 41: e00821. doi: 10.1016/j.btre.2023.e00821. [ Links ]
42. Olivares-Ferretti P, Hernandez K, Peredo-Parada M, Chavez V, Carmona E, Astuya A, Parodi J. 2019. Polyphenols obtained from Didymosphenia geminata (Lyngbye) Schmith altered the viability and proliferation of salmonids cells lines SHK-1 and CHSE 214. Aquat Toxicol 211: 141-147. doi: 10.1016/j.aquatox.2019.03.022. [ Links ]
43. Olivares-Ferretti P, Sánchez R, Ochoa de la Paz L, Parodi J. 2020. A synergy of the nutritional additives taurine and silymarin in salmon farming: evaluation with the CHSE-214 cellular model. Fish Physiol Biochem 46: 945-952. doi: 10.1007/s10695-020-00760-5. [ Links ]
44. Olivares P, Sanchez R, Carmona E, Astuya A, Herrera H, Parodi J. 2016. Nucleotides and effect over starving condition on fish SHK-1 cells model. J Aquac Res Dev 7: 9. doi: 10.4172/21559546.1000448. [ Links ]
45. Ormeño D, Romero F, López-Fenner J, Ávila Á, Martínez-Torres A, Parodi J. 2013. Ethanol reduces amyloid aggregation in vitro and prevents toxicity in cell lines. Arch Med Res 44: 1-7. doi: 10.1016/j.arcmed.2012.12.004. [ Links ]
46. Ou-Yang ZL, Huang XH, Huang EY, Huang YH, Gong J, Sun JJ, Qin QW. 2010. Establishment and characterization of a new marine fish cell line derived from red-spotted grouper Epinephelus akaara. J Fish Biol 77: 1083-1095. doi: 10.1111/j.1095-8649.2010.02749.x. [ Links ]
47. Parameswaran V, Shukla R, Bhonde R, Hameed ASS. 2006. Establishment of embryonic cell line from sea bass (Lates calcarifer) for virus isolation. J Virol Methods 137: 309-316. doi: 10.1016/j.jviromet.2006.07.006. [ Links ]
48. Parodi J, Flores C, Aguayo C, Rudolph MI, Casanello P, Sobrevia L. 2002. Inhibition of nitrobenzylthioinosine-sensitive adenosine transport by elevated D-glucose involves activation of P2Y2 purinoceptors in human umbilical veinendothelial cells. Circ Res 90: 570-577. doi: 10.1161/01.res.0000012582.11979.8b. [ Links ]
49. Parodi J, Montecinos-Oliva C, Varas R, Alfaro IE, Serrano FG, Varas-Godoy M, Muñoz FJ, et al. 2015. Wnt5a inhibits K(+) currents in hippocampal synapses through nitric oxide production. Mol Cell Neurosci 68: 314-322. doi: 10.1016/j.mcn.2015.08.011. [ Links ]
50. Pasquariello R, Verdile N, Pavlovic R, Panseri S, Schirmer K, Brevini TAL, Gandolfi F. 2021. New stable cell lines derived from the proximal and distal intestine of rainbow trout (Oncorhynchus mykiss) retain several properties observed in vivo. Cells 10: 1555. doi: 10.3390/cells10061555. [ Links ]
51. Ringø, E, Zhou, Z, Vecino, JLG, Wadsworth S, Romero J, Krogdahl A, Olsen RE, et al. 2016. Effect of dietary components on the gut microbiota of aquatic animals. A never ending story? Aquacult Nutr 22: 219-282. doi: 10.1111/anu.12346. [ Links ]
52. Rolland JB, Bouchard D, Coll J, Winton JR. 2005. Combined use of the ASK and SHK-1 cell lines to enhance the detection of infectious salmon anemia virus. J Vet Diagn Invest 17: 151-157. doi: 10.1177/104063870501700209. [ Links ]
53. Saito T, Goto-Kazeto R, Arai K, Yamaha E. 2008. Xenogenesis in teleost fish through generation of germline chimeras by single primordial germ cell transplantation. Biol Reprod 78: 159-166. doi: 10.1095/biolreprod.107.060038. [ Links ]
54. Sanchez R, Olivares P, Carmona E, Astuya A, Herrera H, Parodi J. 2016. Fish nutrition additives in SHK-1 cells: protective effects of silymarin. Adv Biosci Biotechnol 7: 55-62. doi: 10.4236/abb.2016.72007. [ Links ]
55. Scott J, Belden JB, Minghetti M. 2021. Applications of the RTgill-W1 cell line for acute whole-effluent toxicity testing: in vitro-in vivo correlation and optimization of exposure conditions. Environ Toxicol Chem 40: 1050-1061. doi: 10.1002/etc.4947. [ Links ]
56. Segner H. 1998. Fish cell lines as a tool in aquatic toxicology. In: Fish ecotoxicology. Basel: Birkhäuser Basel. p 1-38. doi: 10.1007/978-3-0348-8853-0_1. [ Links ]
57. Segner H, Blair JB, Wirtz G, Miller MR. 1994. Cultured trout liver cells: utilization of substrates and response to hormones. In Vitro Cell Dev Biol Anim 30: 306-311. doi: 10.1007/BF02631451. [ Links ]
58. Shearer K. 2000. Experimental design, statistical analysis and modelling of dietary nutrient requirement studies for fish: a critical review. Aquaculture Nutr 6: 91-102. doi: 10.1046/j.1365-2095.2000.00134.x. [ Links ]
59. Subbiahanadar Chelladurai K, Selvan Christyraj JD, Rajagopalan K, Yesudhason BV, Venkatachalam S, Mohan M, Chellathurai Vasantha N, Selvan Christyraj JRS. 2001. Alternative to FBS in animal cell culture-An overview and future perspective. Heliyon 8: e07686. doi: 10.1016/j.heliyon.2021.e07686. [ Links ]
60. Torrecillas S, Montero D, Izquierdo M. 2014. Improved health and growth of fish fed mannan oligosaccharides: potential mode of action. Fish Shellfish Immunol 36: 525-544. doi: 10.1016/j.fsi.2013.12.029. [ Links ]
61. Wolf K, Gravell M, Malsberger RG. 1966. Lymphocystis virus: isolation and propagation in centrarchid fish cell lines. Science 151: 1004-1005. doi: 10.1126/science.151.3713.1004. [ Links ]
62. Wolf K, Quimby MC. 1962. Established eurythermic line of fish cells in vitro. Science 135: 1065-1066. doi: 10.1126/science.135.3508.1065. [ Links ]
63. Wuest DM, Harcum SW, Lee KH. 2012. Genomics in mammalian cell culture bioprocessing. Biotechnol Adv 30: 629-638. doi: 10.1016/j.biotechadv.2011.10.010. [ Links ]
64. Yadav MK, Rastogi A, Criollo Joaquin MP, Verma DK, Rathore G, Swaminathan TR, Paria A, et al 2021. Establishment and characterization of a continuous cell line from heart of Nile tilapia Oreochromis niloticus and its susceptibility to tilapia lake virus. J Virol Methods 287: 113989. doi: 10.1016/j.jviromet.2020.113989. [ Links ]
65. Yevenes GE, Peoples RW, Tapia JC, Parodi J, Soto X, Olate J, Aguayo LG. 2023. Modulation of glycine-activated ion channel function by G-protein betagamma subunits. Nat Neurosci 6: 819-824. doi: 10.1038/nn1095. [ Links ]
Recibido: 10 de Febrero de 2024; Aprobado: 26 de Enero de 2025
* Autor de correspondencia: Jorge Parodi; jparodi@tonalli-ltda.com

Decano: Dr. Fernando Carcelén Cáceres
Vicedecano Académico y de pregrado: Dr. Alexei Vicent Santiani Acosta
Vicedecano de Investigación y Posgrado: Dr. Raúl Héctor Rosadio Alcántara
Copyright ©2025 Todos los Derechos Reservados
Desarrollado por Unidad de Estadística e Informática de la Facultad de Medicina Veterinaria de la UNMSM